"بی مزه" ، این بیماری دیابت است: کد ICD-10 ، شرح بیماری و اشکال اصلی آن
- Nikita Tyrtov 1 سال پیش بازدید:
1 دیابت قندی (دیابت دیسپیدوس دیابت ، سندرم دیابت بیضه ، دیابت لاتین insipidus) یک بیماری بسیار نادر (تقریباً 3 درصدی) است که با اختلال در عملکرد هیپوتالاموس یا غده هیپوفیز همراه است ، که با پلی اوریا (دفع 6 15 لیتر ادرار در روز) و پلی مایع (تشنگی) همراه است. )
برای اولین بار ، طعم ادرار دیابت را به دیابت قارچ و دیابت مایع و دیابت ویلید ویلیس در سال 1674 تقسیم کرد. شکل خانوادگی دیابت هیپوتالاموس هیپیدیوس اولین بار در سال 1841 توسط لاکومب توصیف شد.
3 ویلیس ، توماس (WILLIS ، توماس ،) اطلاعات دقیق در مورد وضعیت مالی خانواده ویلیس حفظ نشده است ، اما او به وضوح متعلق به افراد مرفه نبود ، زیرا مشخص است که توماس ویلیس به عنوان سرپرست تحصیل در آکسفورد (دانشجویی که به عنوان خادم بورس تحصیلی کار می کند) رفت. ) از سال 1646 تا 1667 ، توماس ویلیس پزشک پزشکی در آکسفورد بود. در ابتدا ، تمرین او چندان موفق نبود ، اما به تدریج بسیار مرفه شد. سوابق مالیاتی باقیمانده نشان می دهد که درآمد سالانه وی بالاترین میزان در آکسفورد بوده است.ممکن است که با افزایش حضور وی در سراسر انگلیس که در 14 دسامبر 1650 در اولین احیاء مستند شناخته شده است ، افزایش محبوبیت در بین بیماران افزایش یابد. وی در سال 1664 كتاب «آناتومی مغز» اثری اساسی در مورد آناتومی سیستم عصبی مرکزی با تصاویر قابل توجه منتشر كرد. در این کتاب بود که مجتمع عروقی در پایه مغز ، که اکنون به عنوان دایره ویلیس شریانی شناخته می شود ، ابتدا با جزئیات توضیح داده شد. بسیاری از افراد به اشتباه نویسندگی را در وصف این شکل گیری به آناتومیست که هرگز موجود نیست ، والیزیوس نسبت می دهند ، اگرچه در واقعیت این به دلیل هجی کردن انگلیسی نام خانوادگی ویلیس است.
4 ویلیس شش بیماری ناشناخته برای علوم پزشکی را تا این زمان توصیف کرد. وی توصیف سرفه های سرفه ، مننژیت ، نارکولپسی در بیماران مبتلا به اسکیزوفرنی ، کاردیواسپاسم و یک روش موفقیت آمیز برای درمان آن ، اولین کسی است که تب پس از زایمان را توصیف کرده و نام آن را می گذارد. وی با در نظر گرفتن آسم برونش ، برانگیختگی سیستم عصبی را یکی از دلایل اصلی حمله عنوان کرد. وی با بیان اینکه در مورد هیستری برخلاف نظر عموماً پذیرفته شده در آن زمان ، تصریح کرد که هیستری یک بیماری رحمی نیست و دلایل این بیماری با اختلال در فعالیت مغز همراه است. وی توصیف حصبه اپیدمی و تب حصبه ، با این حال ، اولین کاری که وی در سال 1659 انجام داد ، زمانی که ویلیس زمان زیادی را برای مطالعه تب اختصاص داد. با تشکر از این کار ، توماس ویلیس بنیانگذار سنت انگلیسی در اپیدمیولوژی است. ویلیس اولین توضیحات بالینی میاستنی (میاستنی گراویس) را ارائه داد
14 دسامبر 1650 - اولین احیاء مستند شده در این روز ، آنا گرین اعدام شد ، به اتهام قتل فرزند خود. این دختر روستایی بیست و دو ساله به عنوان خدمتکار در خانه سر توماس رید کار می کرد و توسط نوه اش اغوا می شد. بعد از اینکه آنا باردار شد ، جفری رید او را رد کرد. ساده لوح آنا گرین بارداری خود را پنهان کرد ، و به همین دلیل هنگام تولد پسر مرده زودرس ، بدن او را پنهان کرد. با این حال ، یک کودک متولد شده پیدا شد ، و ظاهر وحشتناک او باعث شد تا آنا را به قتل متهم کند. وی در بازداشت به سر برد ، و دادگاه او را به مجازاتی كاملاً معمول در آن زمان - اعدام عمومی با آویزان كردن محكوم كرد. بعد از حلق آویز ، آنا گرین حدود نیم ساعت دیگر در حلقه آویزان ماند. جسد او را در تابوت گذاشتند و به خانه دکتر ویلیام پتی ، استاد آناتومی دانشگاه آکسفورد منتقل کردند ، زیرا طبق فرمان پادشاه چارلز اول (1636) ، تمام اجساد کسانی که در 21 مایل آکسفورد اعدام شده بودند منتقل می شدند. دانشکده پزشکی
6 دسامبر 1450 - اولین احیاء مستند. لازم به ذکر است که تا سال 1549 مطالعات آناتومیک در دانشکده پزشکی دانشگاه آکسفورد ممنوع بود. این ممنوعیت توسط پادشاه ادوارد ششم مجبور شد برداشته شود ، با ناراحتی از این واقعیت که پزشکانی که مثانه او را معالجه می کردند نمی دانند چطور چیده شده است. با حکم پادشاه ادوارد ششم ، هر دانشجوی پزشکی مکلف به شرکت در حداقل چهار کالبد شکافی بود که دو مورد از آنها باید به طور مستقل انجام شود. این نوآوری موجب "شکار اجساد" واقعی شد ، و به لطف فرمان فوق الذکر پادشاه چارلز اول سال 1636 ، صدها سال بعد ، راه حل این مشکل پیش آمد. وقتی دکتر ویلیام پتی ، توماس ویلیس ، رالف باتورست (Ralph Bathurst) ، و دیگران برای کالبدشکافی جمع شدند و تابوت را باز کردند ، متوجه شدند که سینه "جسد" حرکات تنفسی را انجام می دهد ، و برخی تند و تیزهای تند و تیز را می شنوید. بلافاصله با ترک افکار در مورد کالبد شکافی آینده ، صاحب نظران شروع به انجام کلیه اقدامات ممکن برای بازگرداندن زن کردند.
7 دسامبر 1650 - اولین احیای مستند. آنها آنا گرین را از تابوت جدا کردند ، دندان های خود را باز کردند و الکل را در دهانشان ریختند. این مسئله باعث ایجاد رفلکس سرفه در "جسد" شد که باعث شد پزشکان مونتاژ شده بازگرداندن آنا گرین را به زندگی حتی با انرژی بیشتری ادامه دهند. آنها شروع به پاک کردن و ماساژ دست و پاهای او کردند. بعد از ربع ساعت پزشکان دوباره یک نوشیدنی قوی را در دهان او ریختند و با پر پرنده شروع به پرخاش کردن گلو کردند ، پس از آن آنا برای لحظه ای چشمانش را باز کرد. سپس او خونریزی شد و 5 اونس خون آزاد شد. پزشکان با ادامه مالش دست و پا ، پلاک هایی را برای اندام آنا به منظور افزایش میزان جریان خون به مغز اعمال کردند. پس از آن ، آنها دوباره به او نوشیدنی قوی دادند و برای افزایش دمای بدن ، یک ورم گرم را تحویل دادند. سپس آنا گرین در کنار زن دیگری که به عنوان "پد گرمایش" عمل می کرد ، در رختخواب قرار گرفت تا گرم شدن بدن قربانی زنده اعدام انجام شود. بعد از دوازده ساعت ، آنا گرین قادر به گفتن چند کلمه بود و روز بعد می توانست به سوالات پاسخ دهد. بعد از 2 روز ، او حافظه خود را به طور کامل برای همه آنچه قبل از لحظه اعدام بود ، بازیابی کرد. بعد از 4 روز ، او قبلاً می توانست غذای جامد بخورد و بعد از یک ماه کاملاً بهبود یابد.
14 دسامبر 1650 - اولین احیاء مستند شده است.در پروتکل بازگشت به زندگی آنا گرین ، دکتر ویلیام پتی و توماس ویلیز با جزئیات و تفصیل مشاهدات خود را در مورد نبض بیمار ، دفعات و نوع تنفس ، وضعیت هوشیاری و حافظه شرح داده اند. دو هفته پس از اعدام ، او به طرز مبهمی شروع به یادآوری وقایع آن روز و برخی از مردها در یك لباس خاكستری ، احتمالاً اعدام كرد. خاطرنشان شد: صورت وی روزها قرمز و براق بود و یک قلاب خفه کننده با چاپ گره برای مدت طولانی روی گردن او باقی ماند. پس از بهبودی کامل ، آنا گرین با تصمیم ویژه دادگاه و رئیس زندان آکسفورد مورد عفو قرار گرفت ، که به طور منطقی استدلال می کرد از آنجا که خداوند خداوند جان آنا گرین را داد ، دادگاه حق ندارد تصمیمات متعال را لغو کند. او به روستای خود بازگشت ، 15 سال دیگر زندگی کرد و سه فرزند به دنیا آورد. این احتمال وجود دارد که این مورد منحصر به فرد از احیای غافلگیرکننده آنا گرین بعنوان یک انگیزه برای پزشکان جوان ، ویلیام پتی و توماس ویلیس ، برای انجام مطالعات پزشکی دقیق تر استفاده شود.
مکانیسم عمل هورمونی ضد دیورتیک
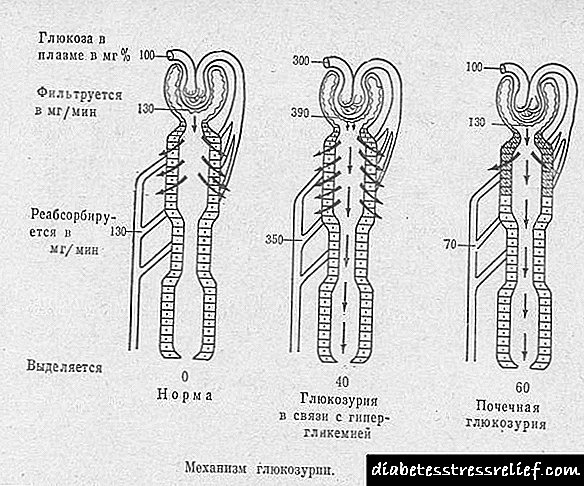
مکانیسم عملکرد ADH مبتنی بر تحریک جذب معکوس آب در لوله های دیستال و جمع آوری لوله های نفرون کلیه است. ادرار اولیه دارای اسمولاریته مشابه پلاسما است. غلظت نهایی ادرار به وجود یا عدم وجود ADH بستگی دارد. در صورت وجود هورمون ، جذب معکوس آب افزایش می یابد و ادرار غلیظ می شود. با کمبود ADH ، ادرار رقیق زیادی آزاد می شود. با ترشح عادی ADH ، اسمولاریته ادرار همیشه بالاتر از 300 mOsm / kg است و می تواند تا 1200 mOsm / kg یا بیشتر افزایش یابد ، با کمبود آن ، اسمولاریت ادرار معمولاً پایین تر از 200 mOsm / kg است. در صورت عدم وجود ترشح ADH و وزن مخصوص ادرار 1001 گرم در لیتر ، میزان اسمولاریته ادرار 33.3 میلی گرم بر کیلوگرم است. برای تعیین میزان اسمولاریته ادرار ، باید دو شکل آخر وزن مخصوص ادرار را با ضریب 33.3 ضرب کنید.

عمل ADH در سطح سلولی از طریق سیستم های فشار هوائی و بارور گیرنده ها انجام می شود ، هر کدام از این سیستم ها مستقل عمل می کنند. Osmoregulation در محدوده بسیار باریک انجام می شود. تغییر در اسمولالیته پلاسما تنها 1٪ باعث ترشح تصحیح ADH می شود ، در حالی که در رابطه با حجم خون ، ترشح ADH زمانی اتفاق می افتد که حجم خون 7-15٪ کاهش یابد ، اما با کاهش سریع در حجم خون (به عنوان مثال با از دست دادن خون) ، واکنش حجمی بیش از اسمولار غالب می شود. ADH در هنگام تغییر موقعیت بدن در حفظ فشار خون نقش دارد ، رگ های خونی را هنگام ایستادن کاهش می دهد و مانع از ریزش ارتوستاتیک می شود.
مکانیسم عمل داخل سلولی ADH فعال سازی کلسیم - کالمودولین ، افزایش سنتز آدنوزین مونوفسفات حلقوی در حضور یون های کلسیم و منیزیم و همچنین فعال کردن سنتز پروستاگلاندین ها (PgE-2) است که به نوبه خود ، عملکرد ADH را غیرفعال می کند. نيمه عمر ADH در افراد سالم و بيماران مبتلا به NSD به طور متوسط حدود 7.3 دقيقه (1 / 4-4 دقيقه) است. غیرفعال سازی ADH عمدتا در کبد (50٪) و کلیه ها (40٪) رخ می دهد. حدود 10٪ از ADH بدون تغییر در ادرار دفع می شود.
در سطح کلیه ، کبد ، سیستم عصبی مرکزی (CNS) ، سلولهای عروقی ، عمل ADH از طریق چندین نوع گیرنده انجام می شود. در سلولهای توبولهای کلیوی ، ADH از طریق گیرنده V2 عمل می کند ، آب را حفظ می کند ، جذب مجدد آن را در کلیه ها تحریک می کند. در کبد ، ADH از طریق گیرنده V1- گیرنده عمل می کند ، که منجر به تجزیه گلیکوژن و فعال سازی فرآیندهای گلوکونوژنز می شود. در سیستم عصبی مرکزی ، ADH از طریق V1-baro- و osmoreceptors بر روی ساختارهای هیپوتالاموس عمل می کند ، به طور مستقیم بر قشر مغز و واکنشهای رفتاری تأثیر می گذارد. او در ادغام حافظه و بسیج اطلاعات ذخیره شده (یعنی کمک به یادآوری و به یاد آوردن به موقع اطلاعات لازم کمک می کند) شرکت می کند. از طریق V3-baroreceptor ، ADH ترشح هورمون آدرنرژیک را در قشر مغز آدنوهیپوفیز تحریک می کند. ADH بر روی رگهای خونی از طریق V1-baro و osmoreceptors عمل می کند ، باعث انقباض لایه عضله صاف و جلوگیری از افت فشار در هنگام ریزش خون و تغییر در موقعیت بدن می شود. علاوه بر این ، گیرنده V1 کلسیم داخل سلولی را بسیج می کند ، باعث تجمع پلاکتی می شود.
دیابتی های دیجیتال
در موارد معمولی ، تشخیص NSD دشوار نیست و براساس شکایات مشخص بیمار از تشنگی ، مصرف زیاد آب و تکرر ادرار بیش از حد ، روز و شب است. آزمایش ادرار زیمیتسکی تشخیص با دیورز 3-20 لیتر در روز با چگالی نسبی ادرار - 1001-1005 گرم در لیتر در کلیه قسمتها را تأیید می کند. بیش فعالی پلاسما بیش از 300 mOsm / kg و هایپرناترمیا - بیش از 155 meq / l در خون تشخیص داده می شود. اسمالی بودن ادرار در مورد NDS 100-200 mOsm / kg 2 ، 7 ، 8 است.
برای بیان اسمولاریت مایعات بدن ، دو اصطلاح وجود دارد: اسمولاریته و اسمولالیته. فشار اسمالی پلاسما ، که به دلیل پروتئین ها و لیپیدهای موجود در آن است ، اسمولالیسم 12 تا 16 mOsm / kg کمتر از اسمولاریته است. اسمولالیته را می توان با فرمول: 2x (K + Na) + گلوکز + اوره محاسبه کرد ، جایی که اسمولالیسم در mOsm / kg ، K ، Na ، گلوکز ، اوره در mmol / l بیان می شود. با اسمولالیته پلاسما 310 mOsm / l و فشار تورمی 12-16 mOsm / L ، اسمولالیسم 275-290 mOsm / kg است.
تعیین ADH در سرم معنی ندارد ، زیرا برای تشخیص NSD ، مهمتر از دانستن شاخص های مطلق غلظت هورمون در پلاسما خون ، بلکه نسبت اسمولالیته خون و ادرار است. در مرحله بعد ، تست های تشخیصی افتراقی انجام می شود: یک آزمایش با محدودیت مایعات به منظور حذف polydipsia روانی و آزمایش با دسموپرسین برای حذف NSD نفروژنیک. هنگام تأیید تشخیص NSD مرکزی ، برای تعیین علت بیماری ، تصویربرداری با رزونانس مغناطیسی از مغز انجام می شود و سابقه خانوادگی مورد بررسی قرار می گیرد.
درمان دیابتی
درمان NSD در درجه اول باید اتیولوژیک باشد. در اشکال علامت دار ، ابتدا لازم است درمان بیماری زمینه ای (تومور ، التهاب) انجام شود. با این وجود ، صرف نظر از دلایلی که منجر به ایجاد NSD شد ، در صورت کمبود ADH ، درمان جایگزین کافی لازم است.
داروی اصلی برای درمان NSD در حال حاضر دسموپرسین است که به دو شکل استفاده می شود: به شکل قرص و به صورت اسپری بینی 10 ، 11. دسموپرسین یک آنالوگ مصنوعی وازوپرسین است ، در صورت عدم وجود خاصیت وازوپرسور ، دارای فعالیت ضددردی بالایی است. فعالیت فشار آن فقط 1/4000 از فعالیت وازوپرسور ADH بومی است. این دارو به شکل قرص های 0.1 و 0.2 میلی گرم استفاده می شود ، به مدت 7-12 ساعت عمل می کند ، به خوبی تحمل می شود ، بسیار مؤثر است ، بندرت واکنش آلرژیک می دهد. آنالوگ های مصنوعی وازوپرسین با موفقیت در زنان باردار استفاده می شود ، زیرا به دوز زیادی احتیاج ندارید و حاوی اکسی توسین نیستید که باعث افزایش لحن رحم می شود. دسموپرسین همچنین ممکن است در بیماران مبتلا به NSD نفروژنیک که حساسیت باقیمانده به ADH دارند ، مؤثر باشد.
هنگام استفاده از داروهای زیاد دارو ، علائم مشخصه احتباس مایعات در بدن ممکن است رخ دهد: سردردهای شدید گذرا ، تهوع ، افزایش متوسط فشار خون. در صورت مصرف بیش از حد ، فشار خون بالا پلاسما ، تا مسمومیت با آب مشاهده می شود: درد شکم ، استفراغ ، اسهال ، تشنج صرع. این پدیده ها ماهیت گذرا دارند و با کاهش دوز یا ترک دارو از بین می روند. دوز اولیه دسموپرسین برای بزرگسالان و کودکان 0.1 میلی گرم 3 بار در روز است. سپس لازم است یک دوز را با در نظر گرفتن رفاه بیمار و همچنین عادی سازی وزن مخصوص ادرار و خروج ادرار انتخاب کنید.
ما نمونه ای از انتخاب یک دوز دسموپرسین را ارائه می دهیم. بیمار مبتلا به NSD از پیدایش مرکزی ، دسموپرسین 0.2 میلی گرم 3 بار در روز را دریافت کرد ، با این حال ، احساس ناخوشایندی داشت ، بدون پدیده آب مروارید ، دما را تا 5/38 درجه سانتیگراد افزایش داد ، میزان خروجی ادرار روزانه 7 تا 8 لیتر در روز بود. در آزمایش ادرار زیمیتسکی ، در تمام بخش های ادرار یک شب ادراری شبانه روز و وزن مخصوص کم (1001-1003 گرم در لیتر) وجود داشت (جدول 1).
دوز دسموپرسین به 0.3 میلی گرم 3 بار در روز افزایش یافت. وضعیت بهداشتی بیمار در واقع تغییر نکرده است ، وضعیت فرعی باقی مانده است. دیورز کمی کاهش یافته است: از 7.280 به 6.550 لیتر در روز (جدول 2).
افزایش دوز دسموپرسین به 0.4 میلی گرم 3 بار در روز منجر به عادی سازی وزن مخصوص ادرار شد (جدول 3). علیرغم این واقعیت که دیورز بالا باقی مانده است - 3400 لیتر ، بیمار زحمت کشید. در عین حال ، وی از سلامتی و عادی سازی دمای بدن یاد کرد.
بنابراین ، انتخاب دقیق تری از دوز دارو مجاز است تا کیفیت زندگی بیمار را به میزان قابل توجهی بهبود بخشد و ارزیابی کفایت درمان را عینیت دهد.
دسموپرسین داخلی در قرص های 0.1 و 0.2 میلی گرم مشابه یک داروی خارجی است. دسموپرسین به شکل اسپری دوز بینی در فدراسیون روسیه ثبت می شود. 1 دوز دارو حاوی 10 میکروگرم از ماده فعال است ، دوز روزانه برای استفاده داخل رحمی در بزرگسالان 10-40 میکروگرم در روز در 1 یا 2 دوز است. با تورم مخاط بینی یا رینیت شدید ، تجویز زیر زبانی دسموپرسین توصیه می شود. هنگام جابجایی از یک فرم زیر زبانه به اسپری بینی ، افزایش دوز 1.5 برابر نیاز است.
درمان NSD نفروژنیک بسیار مشکل تر است.از داروهایی استفاده کنید که با هدف کاهش هضم و تشنگی انجام شود. برخی از داروها باعث ایجاد اثر متناقض در بیماران مبتلا به NSD می شوند. به عنوان مثال ، دیورتیک های تیازیدی که در بیماران مبتلا به NSD با کاهش میزان خروجی ادرار 50-60٪ باعث کاهش تصفیه گلومرولی و دفع سدیم می شوند. نیاز به دوباره پر کردن پتاسیم را در نظر داشته باشید. درمان ترکیبی با دیورتیک های تیازیدی با داروهای پتاسیم در درمان NSD همراه با فشار خون داخل جمجمه مؤثر است.
داروی کاهنده قند کلرپروپامید دارای خاصیت ضد ضایعات مهمی است و می توان از آن با ترکیبی از دیابت و دیابت مایع استفاده کرد. داروهای ضد تومور ، عصب گیران ، نیکوتین می توانند ترشح ADH را تحریک کنند. الکل اتیل در صورت NSD اثر پارادوکسیکال دارد و دیورز را کاهش می دهد. داروهای ضد التهابی غیر استروئیدی می توانند اثر ADH را نیز تقویت کنند PgE2 را مسدود کرده و از غیرفعال شدن آن در کلیه جلوگیری می کند.
انواع دیابت
در زیر ، یک طبقه بندی مدرن ارائه خواهد شد ، که بر اساس آن می توانید انواع بیماری های مرتبط با دیابت را مشاهده کنید. دیابت بیضه با عطش شدید مشخص می شود ، که با آزاد شدن مقدار زیادی ادرار غیرمرکز (حداکثر 20 لیتر در روز) همراه است ، در حالی که سطح گلوکز خون در حد طبیعی است.
بسته به علت ، به دو گروه بزرگ تقسیم می شود:

- نفروژنیک آسیب شناسی کلیوی اولیه ، ناتوانی نفرون در تمرکز ادرار به دلیل کمبود گیرنده های هورمون ضد دیورتیک ،
- عصبی. هیپوتالاموس مقدار کافی وازوپرسین (هورمون ضد ادراری ، ADH) تولید نمی کند ، که آب را در بدن ذخیره می کند.
نوع اصلی آسیب شناسی پس از سانحه یا بعد از عارضه پس از سانحه ، هنگامی مهم است که در نتیجه آسیب به مغز و ساختار سیستم هیپوتالاموس هیپوفیز ، اختلالات تلفظ شده توسط الکترولیت آب ایجاد شود.
انواع متداول دیابت:

- نوع 1. تخریب خودکار سلول های پانکراس غدد درون ریز که انسولین تولید می کنند (هورمونی که قند خون را پایین می آورد) ،
- نوع 2. اختلال در متابولیسم گلوکز در زمینه عدم حساسیت بیشتر بافتها به انسولین ،
- دیابت حاملگی. در گذشته زنان سالم در دوران بارداری میزان گلوکز و علائم مرتبط با آن را بالا برده اند. پس از زایمان به خود بهبود می یابد.
تعدادی از انواع نادر وجود دارد که به نسبت 1: 1 000،000 در جمعیت یافت می شوند ؛ آنها مورد توجه مراکز تحقیقاتی تخصصی هستند:
- دیابت و ناشنوایی. بیماری میتوکندری که مبتنی بر نقض بیان برخی ژن ها است ،
- خود ایمنی نهفته. تخریب سلول های بتا جزایر لانگرهان در لوزالمعده ، که در بزرگسالی تجلی می یابد ،
- لیپواتروفیک در برابر پس زمینه بیماری زمینه ای ، آتروفی چربی زیر جلدی ایجاد می شود ،
- نوزادان. شکلی که در کودکان زیر 6 ماه رخ می دهد ممکن است موقتی باشد.
- پیش دیابت. شرایطی که تمام ضوابط تشخیصی برای یک حکم نهایی در آن وجود ندارد ،
- ناشی از استروئید. افزایش طولانی مدت سطح گلوکز در خون در طی درمان با هورمونهای گلوکوکورتیکوئید می تواند باعث ایجاد مقاومت به انسولین شود.
در اکثر موارد ، تشخیص مشکل نیست. اشکال نادر برای مدت طولانی به دلیل تغییر در تصویر بالینی کشف نشده است.
دیابت مایع چیست؟
 این وضعیتی است که با وجود تشنگی شدید و دفع بیش از حد ادرار غیرمتمرکز مشخص می شود.
این وضعیتی است که با وجود تشنگی شدید و دفع بیش از حد ادرار غیرمتمرکز مشخص می شود.
در برابر پس زمینه از دست دادن آب و الکترولیتها ، کم آبی بدن و عوارض تهدید کننده زندگی (آسیب به مغز ، قلب) ایجاد می شود.
بیماران به دلیل چسبیدن به توالت ناراحتی قابل توجهی دارند. اگر مراقبت های پزشکی به موقع ارائه نشود ، تقریباً همیشه یک نتیجه کشنده اتفاق می افتد.
4 نوع دیابت وجود دارد:

- فرم مرکزی. غده هیپوفیز وازوپرسین کمی تولید می کند که گیرنده های aquaporin موجود در نفرون ها را فعال می کند و جذب مجدد آب آزاد را افزایش می دهد. از علل اصلی آسیب دیدگی به غده هیپوفیز یا ناهنجاری های ژنتیکی در ایجاد غده است.
- شکل نفروتیک کلیه ها به محرک های وازوپرسین پاسخ نمی دهند. اغلب این یک آسیب شناسی ارثی است ،
- در بارداری. بسیار نادر است و می تواند عواقب خطرناکی را برای مادر و جنین ایجاد کند ،
- فرم مخلوط. بیشتر اوقات ویژگی های دو نوع اول را ترکیب می کند.
درمان شامل نوشیدن مایعات کافی برای جلوگیری از کم آبی بدن است. سایر روشهای درمانی بستگی به نوع دیابت دارد. فرم مرکزی یا حاملگی با دسموپرسین (آنالوگ وازوپرسین) درمان می شود. با استفاده از نفروژنیک ، دیورتیک های تیازیدی تجویز می شوند که در این حالت خاصیت پارادوکسیکال دارند.
فیلم های مرتبط
تعداد موارد جدید دیابت بیضه سالانه 3: 100000 است. شکل اصلی عمدتا بین 10 تا 20 سال زندگی ایجاد می شود ، اغلب زنان و مردان نیز رنج می برند. فرم کلیوی دارای درجه بندی دقیق سنی نیست. بنابراین ، مسئله مرتبط است و نیاز به تحقیقات بیشتر دارد.
- سطح قند را برای مدت طولانی تثبیت می کند
- تولید انسولین لوزالمعده را بازیابی می کند
بیشتر بدانید دارویی نیست ->