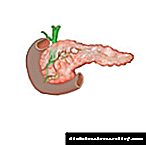
آرشیو درمانی شماره 03 2018 - هموکروماتوز - وضعیت فعلی مشکل

هموکروماتوز یک آسیب شناسی ارثی است که با جذب بالای آهن در اندام های گوارشی و تجمع بیش از حد متعاقب آن در اندام های مختلف داخلی همراه است.
کبد بیش از دیگران رنج می برد. تشخیص زودرس هموکروماتوز ، تشخیص و درمان آن اجازه ایجاد عواقب را نخواهد داد.
هموکروماتوز - شرایط مدرن مشکل
N.B. VOLOSHINА1 ، M.F. OSIPENKO1 ، N.V. LITVINOVA1 ، A.N.VOLOSHIN2
1 دانشگاه پزشکی دولتی نووسیبیرسک FGBOU در NSMU وزارت بهداشت روسیه ، روسیه ،
بیمارستان بالینی 2Novosibirsk 2 ، روسیه
سندرم اضافه بار آهن می تواند با حالتهای مختلف اکتسابی و عوامل ارثی همراه باشد. هموکروماتوز ارثی شایعترین اختلال ژنتیکی است. بدون مداخله درمانی این بیماری می تواند منجر به ایجاد عوارض تهدید کننده زندگی مانند سیروز ، کارسینوم کبدی شود. در این مقاله داده هایی از پاتوژنز ، تشخیص و درمان هموکروماتوز ارثی ارائه شده است. مشاهده بالینی خود داده می شود.
کلمات کلیدی: هموکروماتوز ارثی ، درمان ، فلبوتومی.
 هموکروماتوز نوعی بیماری است که با تجمع مقادیر بالای پاتولوژیک آهن در بدن همراه است که منجر به اختلالات عملکردی برخی ارگان ها می شود. به طور معمول ، جذب آهن کاملاً تنظیم می شود ، در نتیجه بدن قادر به ترشح آهن اضافی نیست. آهن اضافی به عنوان hemosiderin در سلول ها تجمع می یابد. این در نهایت منجر به مرگ سلولی و جایگزینی این سلول ها با بافت فیبری می شود که منجر به اختلال در ساختار و عملکرد اندام ها می شود. با هموکروماتوز ، آسیب به کبد ، لوزالمعده ، قلب ، غده تیروئید ، مفاصل ، پوست ، غدد جنسی و غده هیپوفیز امکان پذیر است.
هموکروماتوز نوعی بیماری است که با تجمع مقادیر بالای پاتولوژیک آهن در بدن همراه است که منجر به اختلالات عملکردی برخی ارگان ها می شود. به طور معمول ، جذب آهن کاملاً تنظیم می شود ، در نتیجه بدن قادر به ترشح آهن اضافی نیست. آهن اضافی به عنوان hemosiderin در سلول ها تجمع می یابد. این در نهایت منجر به مرگ سلولی و جایگزینی این سلول ها با بافت فیبری می شود که منجر به اختلال در ساختار و عملکرد اندام ها می شود. با هموکروماتوز ، آسیب به کبد ، لوزالمعده ، قلب ، غده تیروئید ، مفاصل ، پوست ، غدد جنسی و غده هیپوفیز امکان پذیر است.
اضافه بار آهن ، که باعث هموکروماتوز می شود ، می تواند از سه طریق اتفاق بیفتد: جذب سنگین آهن خوراکی ، افزایش جذب آهن در هنگام مصرف آهن طبیعی و تولید بیش از حد یا انتقال گسترده و مکرر گلبول های قرمز.
در هموکروماتوز ارثی ، آهن بیش از حد معمولاً در سلولهای پارانشیمی قرار می گیرد ، در حالی که در هموکروماتوز انتقال خون عمدتاً در سلولهای رتیکولو آندوتلیال 1-3 ذخیره می شود.
هموکروماتوز ارثی شامل گروهی از اختلالات ژنتیکی است که با افزایش جذب آهن مشخص می شود. مکانیسم غالب در اکثر انواع هموکروماتوز ارثی اثر هپسیدین است که نقش اصلی در هموستاز آهن 4-6 دارد. هپسیدین به طور عمده در سلولهای کبدی سنتز می شود و غلظت آهن در پلاسما را با اتصال به فروپورتین (که به آن SLC40A1 نیز گفته می شود) کنترل می کند ، تنها انتقال دهنده مشهور انتقال دهنده آهن از بافتهای دهنده آهن است. فروپورتین آهن را از اثنی عشر ، از ماکروفاژها و سلولهای کبدی صادر می کند.
در پلاسما ، آهن به ترانسفرین متصل می شود ، بنابراین اشباع آهن با ترانسفرین به طور متوسط 35٪ (مقدار متوسط صبح) است. هپسیدین با اتصال به فروپورتین ، از انتشار آهن از ماکروفاژها (از گلبول های قرمز قرمز قدیمی و فریتین) ، سلولهای کبدی و انتروسیتهای اثنی عشر جلوگیری می کند. و در صورت عدم وجود فروپورتین ، خروجی آهن از انتروسیت ها ، سلولهای کبدی و ماکروفاژها مسدود می شود. بنابراین ، هپسیدین جذب آهن در روده را کاهش می دهد ، سطح آهن آزاد شده از سلولهای کبدی و ماکروفاژها را کاهش می دهد ، که منجر به پایین آمدن آهن در پلاسما و افزایش بافت ها می شود.
علت هموکروماتوز ارثی جهش در ژن HFE است. این نقص در ژن HFE برای اولین بار در سال 1996 شرح داده شد که جهش منجر به جایگزینی تیروزین با سیستئین در موقعیت اسید آمینه 282 (C282Y) است. جهش در ژن HFE علیرغم مصرف طبیعی آهن باعث افزایش جذب آهن می شود. پروتئین HFE تولید هپسیدین را تنظیم می کند. بیماران مبتلا به هموکروماتوز هموکروماتوز ارثی C282Y از 80 تا 85 1 1 ، 8 هستند.
دو جهش دیگر وجود دارد: یکی با جایگزینی آسپارتات با هیستیدین در موقعیت 63 (H63D) و دیگری جایگزینی سیستئین با سرین در موقعیت 65 (S65C). این جهشها به سندرم اضافه بار آهن مربوط نمی شوند ، مگر اینکه C282Y جزئی جدایی ناپذیر از هتروزیگوهای C282Y / H63D یا C282Y / S65C باشد. بنابراین ، فرم مرتبط با HFE از هموکروماتوز ارثی می تواند با یک دوره بدون علامت بیماری تأیید شود. بر این اساس ، تشخیص ژنتیکی را می توان در بیمارانی که هموکروماتوز در آنها هنوز فنوتیپی ایجاد نشده است ، اعمال کرد. این گروه از بیماران مستعد ژنتیکی به هموکروماتوز. هتروزیگوتها در مقایسه با جمعیت عمومی خطر ابتلا به دیابت را افزایش داده اند ، مکانیسم توسعه ناشناخته 9-11 است.
پیش از این تصور می شد که در کلیه بیماران مبتلا به نقص ژن HFE ، یک کلینیک هموکروماتوز با گذشت زمان ایجاد می شود. با این حال ، اکنون مشخص شده است که بیان فنوتیپی تنها در حدود 70٪ از هموزیگوت های C282Y یافت می شود ، و کمتر از 10٪ از آنها با اضافه آسیب به اندام های داخلی 12 ، 13 بیش از حد شدید آهن ایجاد می کنند.
جدول طبقه بندی سندرمهای اضافه بار آهن را بسته به علت وقوع آن نشان می دهد.
بسته به علت این بیماری ، بیماران مبتلا به سندرم اضافه بار آهن را می توان به 4 گروه تقسیم کرد: بیماران مبتلا به هموکروماتوز ارثی ، بیماران مبتلا به هموکروماتوز ثانویه ناشی از دلایل مختلف ، و گروه کوچکی از بیماران که از نظر ظاهری "متفاوت" است.
علت هموکروماتوز ثانویه هموکروماتوز اریتروپویت است. غالباً این اتفاق در نتیجه بیماری خونی اساسی رخ می دهد که در آن گلبول های قرمز طول عمر کوتاه تری دارند. این گروه از بیماریها شامل کم خونی فقر آهن ، تالاسمی ، کم خونی سیدروبلاستیک ، کم خونی همولیتیک مزمن ، کم خونی آپلاستیک ، کم خونی حساس به پیریدوکسین ، کمبود پیروات کیناز است.
سندرم اضافه بار آهن ممکن است در بیمارانی که دریافت طولانی مدت و متعدد انتقال گلبولهای قرمز خون رخ می دهد رخ دهد. همانطور که از جدول مشاهده می شود ، سایر بیماریهای بسیار نادر مانند مثلاً پورفیری نیز می توانند باعث سندرم اضافه بار آهن شوند.
سرانجام ، مصرف بیش از حد آهن می تواند باعث هموکروماتوز شود. واقعیت شناخته شده تاریخی: استفاده از آبجو ساخته شده در طبل های فلزی دلیل سندرم اضافه بار آهن بود. همچنین ، استفاده بیش از حد از آماده سازی آهن می تواند باعث سندرم اضافه بار آهن شود. لازم به یادآوری است که بسیاری از مکمل های غذایی بدون نسخه حاوی آهن با دوز کافی و کافی هستند ، بنابراین استفاده از کنترل نشده آنها غیرقابل قبول است.
علائم این بیماری به ارگانی که بیشترین تأثیر را دارد بستگی دارد ، با این حال ، تقریباً همه بیماران از ضعف و خستگی قابل توجه شکایت دارند. علائم خاصی از هموکروماتوز وجود ندارد. بیشتر اوقات ، تشخیص در مرحله بیماری انجام می شود ، در حالی که چندین سیستم در حال حاضر تحت تأثیر قرار گرفته اند. از اولین علائم بیماری تا تأیید تشخیص معمولاً حداقل ده سال طول می کشد. در زنان مبتلا به هموکروماتوز ، علائم این بیماری در سنین پایین تر از مردان ظاهر می شود ، به دلیل ریزش خون قاعدگی ، از بین رفتن "آهن مادر" در دوران بارداری و اثر آنتی اکسیدانی استروژن ، و این بیماری قبل از دوره آب و هوایی از نظر بالینی ظاهر نمی شود.
تقریباً 50٪ بیماران دارای علائم هموکروماتوز ارثی مبتلا به دیابت هستند ، خطر بروز آن در هتروزیگوتها به میزان قابل توجهی افزایش می یابد. سیروز کبدی در 70٪ بیماران هموکروماتوز وجود دارد. در این گروه از بیماران ، شیوع کارسینوم کبدی که عامل اصلی مرگ است ، به طور قابل توجهی افزایش یافته است.
آسیب مفاصل با هموکروماتوز به صورت آرتروالژی (معمولاً مفاصل دوم و سوم متاکارپوفانژال) بروز می کند. ناهنجاری های مفصل با هموکروماتوز معمولاً رخ نمی دهد ، اگرچه تغییرات مفصل دژنراتیو امکان پذیر است. در این بیماران ، به طور معمول ، کریستالهای پیرو فسفات کلسیم در مایع سینوویال یافت می شود. این مشخصه پلی آرتریت همراه با هموکروماتوز است که حتی پس از عادی سازی ذخایر آهن ، هنوز هم می تواند پیشرفت کند.
دفع آهن در فیبرهای عضله قلب و سلولهای سیستم هدایت قلب می تواند با ایجاد بیشتر نارسایی قلبی منجر به اختلال در ریتم قلب و یا کاردیومیوپاتی گشاد شده شود. در بعضی موارد ، بعد از عادی سازی سطح آهن در بدن 9-12 جبران کامل نارسایی بطن چپ وجود دارد.
با هموکروماتوز ، ایجاد هیپوگنادیسم و بر همین اساس ناتوانی جنسی به دلیل نارسایی هیپوتالاموس و / یا هیپوفیز ، و منجر به نقض آزاد شدن هورمون گنادوتروپین می شود. در موارد ذخیره بیش از حد آهن 5 بار یا بیشتر ، پراش پراشمی پوست رخ می دهد ، که نتیجه رسوب آهن و ملانین است. اضافه بار آهن ماکروفاژها می تواند منجر به اختلال فاگوسیتوز و کاهش ایمنی شود که منجر به افزایش خطر عفونت از لیستریا ، Yersinia enterocolitica و Vibrio vulnificus می شود. دفع آهن در غده تیروئید معمولاً باعث کم کاری تیروئید می شود.
مرحله توسعه یافته hemochromatosis با وجود سیروز ، دیابت قندی و رنگدانه های پوستی (به اصطلاح دیابت برنز) مشخص می شود. در بیمارانی که از الکل سوءاستفاده می کنند و به هپاتیت B و / یا C آلوده هستند ، آسیب شناسی کبد و لوزالمعده مرتبط با هموکروماتوز به میزان قابل توجهی شدیدتر از 1-3 ادامه می یابد.
نمودار اقدامات تشخیصی برای هموکروماتوز مشکوک را نشان می دهد. مشخص است که فقط حدود 70٪ از هموزیگوت های C282Y دارای سطح فریتین بالایی هستند که مربوط به افزایش ذخیره آهن است و تنها درصد کمی از این بیماران تظاهرات بالینی این بیماری را نشان می دهند. البته همه بیماران با علائمی که ممکن است همراه با هموکروماتوز باشد ، باید از نظر معاینه بیشتر تحت آزمایش قرار گیرند تا این بیماری از بین برود. توجه ویژه ای باید به بیماران با ضعف بی تحرک ، آرتروالژی ، درد در ربع فوقانی راست شکم ، ناتوانی جنسی ، کاهش میل جنسی ، سندرم نارسایی قلبی ، رنگدانه های پوستی و دیابت انجام شود. علاوه بر این ، در کلیه بیماران مبتلا به هپاتومگالی ، سندرم سیتولیتیک ، با مرحله سیروزاتیک بیماری ، لازم است علاوه بر تمام علل اتیولوژیک احتمالی این بیماری ، احتمال هموکروماتوز را به خاطر بسپارید. البته هموکروماتوز ارثی باید در بیمارانی که بستگان درجه یک خویشاوندی آنها مبتلا به هموکروماتوز هستند ، کنار گذاشته شود. 
مطالعه باید با اندازه گیری اشباع ترانسفرین سرم یا غلظت فریتین سرم شروع شود. لازم به ذکر است تعیین ترانسفرین در موارد هموکروماتوز اریتروپویتیک برای تأیید سندرم اضافه بار آهن چندان مؤثر نیست. ویژگی فریتین تا حد زیادی به وجود بیماریهای التهابی بستگی دارد. اگر میزان فریتین بالاتر از 200 میکروگرم بر لیتر در خانمها یا 300 میکروگرم بر لیتر در آقایان یا اشباع ترانسفرین در خانمها بیش از 40٪ یا در مردان 50٪ باشد ، آزمایشات بیشتر برای حذف هموکروماتوز 1 ، 2 ، 10 ، 11 لازم است.
مطابق توصیه های انجمن آمریكا برای مطالعه بیماری های كبدی 2011 (AASLD 2011) در صورتی كه بیمار ترانسفرین سرمی 1000 میلی گرم در لیتر داشته باشد و بسته به این شاخص ها ، تصمیم گیری در مورد تاكتیك های درمانی و نیاز به بیوپسی كبد انجام می شود (نمودار را ببینید )
در بیمارانی که ترکیبی از هتروزیگوت C288Y / H63D و همچنین هتروزیگوت C288Y دارند یا نه C288Y ، از بین بردن دقیق سایر بیماری های کبد یا خون لازم است (در صورت لزوم ، بیوپسی سوراخ کبد لازم است) و سپس تصمیم گیری در مورد خون ریزی درمانی صورت می گیرد.
هیچ مدرک موثقی مبنی بر تأثیر رژیم های غذایی خاص در شروع یا پیشرفت هموکروماتوز وجود ندارد. با این حال ، برخی از نویسندگان بر این باورند که بیماران مبتلا به هموکروماتوز ارثی رژیم غذایی به استثنای چای و میوه های مرکبات نشان داده می شوند ، که به نظر آنها ، در تجمع آهن نقش دارد. البته الکل که ماده اصلی کبدی است ، باید برای بیماران مبتلا به هموکروماتوز به شدت ممنوع باشد. علاوه بر این ، اتانول ثابت شده است که باعث کاهش سنتز هپسیدین 20 ، 21 می شود.
درمان اصلی هموکروماتوز اولیه خونریزی است. کاهش تعداد گلبول های قرمز ، که اصلی ترین عامل تحریک آهن در بدن است ، از این طریق اثر سمی آهن را کاهش داده و به حداقل می رساند. بیماران ممکن است به 50-100 گلبول خون در سال ، 500 میلی لیتر در هر ، برای پایین آمدن سطح آهن به حالت عادی نیاز داشته باشند. پس از نرمال شدن سطح آهن ، مادام العمر ، اما خونریزی مکرر مورد نیاز است ، معمولاً 3-4 بار در سال. هدف از خون ریزی ، حفظ سطح فریتین 50-100 میکروگرم بر لیتر است. در موارد کاهش قابل توجه هموگلوبین بعد از گل دهی ، درمان مشترک با اریتروپویتین توصیه می شود.
اگر هموکروماتوز در مراحل اولیه بیماری تشخیص داده شود ، درمان خونریزی می تواند از اختلال در عملکرد اندام های آسیب دیده جلوگیری کند و از این طریق امید به زندگی بیمار افزایش یابد. با این حال ، بیماران به ندرت بیش از دو سال پس از تشخیص ، در موارد تشخیص دیرهنگام در مرحله تظاهرات بالینی دقیق 22 ، 23 زندگی می کنند.
طبق گزارش اتحادیه اروپا برای مطالعه کبد (EASL 2010) ، نشانه هایی برای خون ریزی درمانی میزان بالای فریتین سرم است. توصیه می شود خون ریزی درمانی با حجم 400-500 میلی لیتر یک بار در هفته یا هر 2 هفته یک بار انجام شود تا زمانی که به سطح فریتین 45٪ برسد و افزایش قابل توجهی در فریتین سرم تا 1444 میکروگرم بر لیتر ، تشخیص هموکروماتوز غیر قابل انکار باشد. نمونه های DNA برای جهش در ژن HFE مورد تجزیه و تحلیل قرار گرفتند - جهش C282Y (C.845 G> A) در حالت هموزیگوت s.845A / s.845 A یافت شد.
بنابراین ، تشخیص بیمار K. هموکروماتوز ارثی است ، یک جهش هموزیگوت در ژن HFE (C288Y / C288Y) با آسیب غالب کبد ، فیبروز درجه یک (FibroScan ، Metavir 6.6 kPa).
دیر بروز و تشخیص بیماری در سن 58 سالگی در سال 2015 به دلیل جبران طولانی مدت بیماری به دلیل ریزش خون شدید ناشی از خون قاعدگی ، اهدای خون و از دست دادن خون در خاتمه حاملگی و زایمان است.
قابل توجه است که 8 سال از اولین نشانه های بیماری به تایید تشخیص رسیده است! از اواخر سال 2015 ، به بیمار درمانی تجویز شده است - خونریزی 500 میلی لیتر یک بار در هفته. بيمار كه خون را به خوبي تحمل مي كند ، بعد از اولين عمل ، بهبود چشمگيري در شرايط نشان داد. آزمایش خون عمومی و فریتین خون بررسی شد که سطح آن به تدریج کاهش می یابد. درمجموع ، بیش از 100 خونریزی در 2 سال انجام شده است ، اما تا به امروز ، سطح ترانسفرین هدف (100 میکروگرم بر لیتر) به دلیل این واقعیت که بیمار بطور دوره ای از این روش پرش می کند ، نتوانسته است سلامتی خود را توضیح دهد. در حال حاضر ، بیمار به درمان خود ادامه می دهد ؛ وی موفق شد او را از نیاز به درمان مادام العمر متقاعد کند.
بنابراین باید به خاطر داشت که در صورت وجود سندرم سیتولیتیک در بیماران ، هموکروماتوز ارثی باید در جستجوی تشخیصی قرار گیرد. درمان انتخابی برای هموکروماتوز ارثی در حال حاضر خون ریزی است. درمان کافی که به موقع شروع شده است ، از جلوگیری از پیشرفت مرحله سیروز (سیروز) بیماری و در نتیجه افزایش امید به زندگی بیماران جلوگیری می کند.
اطلاعات در مورد نویسندگان:
ولوشینا ناتالیا بوریسوونا - نامزد علوم پزشکی ، دانشیار پیشگیری از بیماریهای داخلی دانشکده پزشکی
Osipenko Marina Fedorovna - دکتری علوم پزشکی ، استاد ، رئیس. کافه پیشگیری از بیماریهای داخلی دانشکده پزشکی
ولووشین آندری نیکولاویچ - پزشک بیمارستان کلینیکی شهر نووسیبیرسک 2
هموکروماتوز: این بیماری چیست؟
برای درک ماهیت بیماری ، باید بدانید که آهن به طور عادی چقدر آهن باید داشته باشد. در آقایان آهن حدود 500-1500 میلی گرم و در زنان 300 تا 1000 میلی گرم است. این شاخص ها نه تنها به جنسیت ، بلکه به وزن فرد نیز بستگی دارد. بیش از نیمی از کل آهن موجود در هموگلوبین است.
روزانه حدود 20 میلی گرم از این میکروالمنت با مواد غذایی وارد بدن می شود. از این تعداد ، فقط 1 تا 5/1 میلی گرم در روده جذب می شود. با وجود هموکروماتوز (GC) یا سندروفیلی ، همانطور که این بیماری نیز نامیده می شود ، جذب به 4 میلی گرم در روز افزایش می یابد و آهن به تدریج در بافت های اندام های مختلف تجمع می یابد.
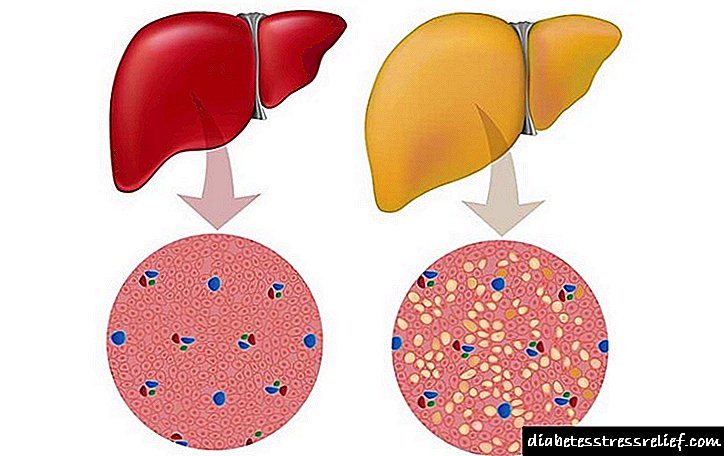
کبد سالم و هموکروماتوز
مقدار اضافی آن ، مولکول های پروتئین و کربوهیدرات ها را از بین می برد ، و از این رو خود ارگان. در بیماران مبتلا به GC ، میزان آهن موجود در کبد می تواند به 1٪ از وزن خشک اندام که مملو از سیروز است و در یک سوم موارد مبتلا به سرطان کبد می رسد. لوزالمعده آسیب دیده به آهن بیش از حد ، می تواند انگیزه ای برای پیشرفت دیابت ایجاد کند.
آهن در غده هیپوفیز قرار دارد و کل سیستم غدد درون ریز را از بین می برد. اندام های تولید مثل بیشتر از دیگران رنج می برند: مردان اختلال نعوظ دارند و زنان می توانند ناباروری ایجاد کنند.
علل
دلیل اصلی GC "عدم عملکرد" ژن یا به اصطلاح ژن HFE است. این اوست که روند فرآیندهای شیمیایی و میزان ورود آهن به عنوان بخشی از غذا را تنظیم می کند. جهش رخ داده در آن منجر به اختلال در متابولیسم آهن می شود.
علل دیگر GC عبارتند از:
- تالاسمی در این حالت ، ساختار هموگلوبین با آزاد شدن آهن از بین می رود ،
- هپاتیت
- آهن ممکن است در اثر انتقال مکرر خون افزایش یابد. واقعیت این است که طول عمر گلبول های قرمز بیگانه بسیار کوتاه تر از خود آنها است. وقتی آنها می میرند ، آهن آزاد می کنند ،
- روش های همودیالیز.
کد ICD-10 و طبقه بندی
در طبقه بندیگر پذیرفته شده بیماریهای GC ، کد E83.1 اختصاص داده شده است.
در یک رگ etilogical ، اولیه (یا GC ارثی) و ثانویه تشخیص داده می شوند:
- اولیه. این نوع بیماری ماهیت ارثی دارد و نتیجه نقص سیستم آنزیمی است که بر متابولیسم آهن تأثیر می گذارد. در 3 نفر از 1000 نفر تشخیص داده شده است. یادآور می شود ، مردان نسبت به زنان بیشتر از زنان آسیب پذیر هستند و 3 برابر بیشتر از خانم ها از آن رنج می برند ،
- ثانویه. علت آن بیماری های کبدی بیمار است (که غالباً با مصرف الکل مشاهده می شود) ، انتقال خون ، خوددرمانی با مجتمع های ویتامین با میزان بالای آهن. علت GC اکتسابی می تواند مشکلات پوستی و بیماری های خونی باشد.
هموکروماتوز اولیه (PCH) با پیشرفت تدریجی مشخص می شود و در مراحل اولیه ، بیماران از خستگی شکایت می کنند. ممکن است از درد در سمت راست و خشکی پوست ناراحت شوند.
مرحله گسترش یافته PCH با این موارد مشخص می شود:
- رنگدانه خاص صورت ، گردن ، بازوها و زیر بغل. آنها رنگ برنز می گیرند ،
- سیروز کبد. در 95٪ موارد تشخیص داده می شود ،
- نارسایی قلبی
- آرتروز
- دیابت قندی: در 50٪ موارد ،
- طحال بزرگ شده ،
- اختلال عملکرد جنسی
در آخرین مراحل ، فشار خون بالا و آسیت پورتال مشاهده می شود. سرطان کبد ممکن است بروز کند.
 از آنجایی که آهن اضافی در طی سالها شکل می گیرد ، علائم اولیه GC ثانویه پس از 40 سال در مردان و در زنان پس از 60 سال بروز می کند.
از آنجایی که آهن اضافی در طی سالها شکل می گیرد ، علائم اولیه GC ثانویه پس از 40 سال در مردان و در زنان پس از 60 سال بروز می کند.
علائم به شرح زیر است:
- ملاسما ،
- خستگی و کاهش وزن ،
- کاهش میل جنسی
- بزرگ شدن و تراکم بافت کبد ،
- سیروز (در آخرین مرحله GC).
آزمایش خون و سایر روشهای تشخیصی
 یک متخصص گوارش تشخیص را تأیید می کند. در مراحل اولیه بیماری ، آزمایشات آزمایشگاهی بسیار مهم است.
یک متخصص گوارش تشخیص را تأیید می کند. در مراحل اولیه بیماری ، آزمایشات آزمایشگاهی بسیار مهم است.
با GC ، آزمایش خون ویژه ای برای تشخیص مقادیر آهن موجود در پلاسما ، توانایی کم اتصال آهن و اشباع آن با ترانسفرین انجام می شود.
علائم اصلی این بیماری رسوب هموسیدرین در سلولهای کبدی کبد ، پوست و اندامهای دیگر است که به دلیل زیاد بودن این رنگدانه ، "زنگ زده" می شوند. آزمایش خون عمومی همچنین برای بیوشیمی و همچنین قند لازم است. علاوه بر این ، آزمایش کبد انجام می شود.
 علاوه بر این ، مطالعات ابزاری نیز انجام می شود:
علاوه بر این ، مطالعات ابزاری نیز انجام می شود:
- بیوپسی کبد راه اصلی تأیید GC است ،
- سونوگرافی شکم
- MRI کبد (در بعضی موارد)
- اکوکاردیوگرافی ، برای رد / تایید کاردیومیوپاتی ،
- رادیوگرافی مشترک
رژیم درمانی
درک این نکته مهم است که با هموکروماتوز تشخیص داده شده ، رژیم غذایی باید مادام العمر باشد.
قانون اصلی کاهش حداکثر در رژیم غذایی محصولات حاوی آهن است ، به ویژه:

- پنیرهای سخت و ماهی های دریایی ،
- غلات: جو دوسر ، ارزن و گندم سیاه ،
- نان سیاه
- حبوبات و میوه های خشک شده ،
- اسید اسکوربیک و داروهای دارای مقدار زیادی ویتامین C ،
- ساق پا به خصوص کبد کاملاً از مطالعه خارج شده است.
الکل یک تابوی مطلق است. اما برعکس ، چای و قهوه نشان داده شده است. آنها دارای تانن هستند ، که جذب آهن را کند می کند.
لیست داروهای مورد استفاده
این درمان با داروهایی انجام می شود که آهن را از بدن بیمار خارج می کند. در مرحله اولیه ، ویتامین های A ، E و اسیدفولیک تجویز می شوند. سپس از شلاتورها (مانند Desferal) استفاده می شود.

دوز تزریق: 1 گرم در روز. در حال حاضر 500 میلی گرم از این دارو نتیجه ملموس می دهد: تا 43 میلی گرم آهن دفع می شود. این دوره تا 1.5 ماه به طول می انجامد. استفاده طولانی مدت خطرناک است: بستن لنز ممکن است.
فلبوتومی و سایر روشهای درمانی
 فلبوتومی ساده ترین و در عین حال درمان غیر داروسازی کاملاً مؤثر از GC است.
فلبوتومی ساده ترین و در عین حال درمان غیر داروسازی کاملاً مؤثر از GC است.
یک سوراخ در رگ بیمار ایجاد می شود و خون از بدن آزاد می شود. در هفته حدود 500 میلی لیتر تخلیه می شود.
این عمل فقط به صورت سرپایی انجام می شود. خون به طور مداوم برای غلظت فرین آزمایش می شود: باید تا 50 کاهش یابد. این امر می تواند 2-3 سال طول بکشد. علاوه بر این ، درمان با هدف حفظ مقدار بهینه این عنصر اثربخشی انجام می شود.
درمان با داروهای مردمی
این روش درمانی بر روی اندامهای بیمار تأثیر ملایم دارد.
درمان کبد:

- کدو تنبل. هم خوب است هم خام و پخته. سبزیجات به سالادها اضافه می شوند یا با عسل مخلوط می شوند - خوشمزه و سالم! آب کدو تنبل نیز نشان داده شده است: نصف لیوان روی معده خالی ،
- چغندر- محصول مفید دیگری برای GC. به صورت خام یا آب پز استفاده کنید. آب سالم و تازه فشرده.
برای درمان قلب می توانید به تزریق زالزالک ، آدونیس یا مادربرد توصیه کنید. گیاهان با آب جوش ریخته می شوند و پس از اصرار ، طبق دستورالعمل مست می شوند.
درمان لوزالمعده:

- جوشانده بذر گیاه چنار کمک خواهد کرد. نسبت ها: 1 قاشق غذاخوری. مواد اولیه به 1 قاشق غذاخوری. آب دانه های دم کرده شده به مدت 5 دقیقه جوشانده می شوند ، قبل از غذا خنک شده و گرفته می شوند ، 1 قاشق غذاخوری. ،
- عسل با دارچین. نسبت ها: 1 قاشق غذاخوری. پودر تا 1 قاشق غذاخوری آب. اصرار کنید 15-30 دقیقه. و مقداری عسل اضافه کنید. 2 ساعت دیگر بگذارید. همه وسایل باید در یک روز مست شوند.
بلغور جو دوسر مفید و پخته (با پوست). نسبت ها: 100 گرم غلات تا 1.5 لیتر آب. حداقل نیم ساعت بجوشانید. سپس درست در کاسه ای که جو دوسر پخته شد ، آن را خرد کنید تا گرم شود و مجدداً به مدت 40 دقیقه جوشانده شود عمر آب مایع فیلتر شده بیش از 2 روز نیست. قبل از غذا نصف لیوان بنوشید.
پیش آگهی و دستورالعمل های اصلی کلینیکی
اما اگر درمان تحت نظارت پزشکی و به موقع انجام شود ، زندگی بیمار به میزان قابل توجهی افزایش می یابد.
به عنوان یک بیماری ارثی ، هموکروماتوز در 25٪ موارد در بستگان بیمار تشخیص داده می شود. بنابراین ، آنها باید بیشتر مورد بررسی قرار گیرند. این امر حتی قبل از تظاهرات بالینی و در آینده برای جلوگیری از عوارض آن ، این بیماری را نشان می دهد.
در مورد GC ثانویه ، رژیم غذایی توصیه می شود ، مهم است که وضعیت کبد و خون را تحت کنترل داشته باشید. هموکروماتوز تشخیص داده شده در دوران بارداری (یا در مرحله برنامه ریزی) خطرناک نیست.
فیلم های مرتبط
درباره علائم ، دلایل و روش های درمانی هموکروماتوز در ویدیو:
متأسفانه هنوز علت اصلی هموکروماتوز مشخص نشده است. اما در حال حاضر ، یک تکنیک ویژه درمانی جامع تهیه شده است و بطور فعال مورد استفاده قرار می گیرد ، هدف از این کار قطع نمودن علائم بالینی بیماری و کاهش خطر عوارض احتمالی آن است.
- سطح قند را برای مدت طولانی تثبیت می کند
- تولید انسولین لوزالمعده را بازیابی می کند
بیشتر بدانید دارویی نیست ->
درمان همزمان بیماری
آهن بیش از حد در اندامها منجر به ایجاد چندین آسیب شناسی می شود. همه آنها نیاز به درمان کمکی دارند. به عنوان مثال ، اگر GC در ایجاد بیماری دیابت نقش داشته باشد ، باید دومی معالجه شود ، همیشه میزان قند را تحت کنترل نگه می دارد.
اگر آسیب شناسی در کبد تشخیص داده شود ، درمان آن ادامه دارد. این امر به منظور جلوگیری از ایجاد پاتولوژی به وضعیت تومور بدخیم ضروری است.
هموکروماتوز
هموکروماتوز ارثی (NG) یک بیماری پلی سیستماتیک است که مبتنی بر اختلالات متابولیکی متابولیک آهن است که منجر به تجمع بیش از حد آن در بدن و آسیب سمی به اندام ها و بافت ها می شود.
اولین توصیف بیماری متعلق به A. Trousseau (1865) است که یک تری از تظاهرات بالینی اصلی را مشخص کرد: دیابت قندی ، رنگدانه پوستی برنز ، سیروز. اصطلاح "هموکروماتوز" در سال 1889 توسط F.D. فون رکلینگهاوزن. از سال 1935 ، این بیماری متعلق به گروه بیماریهای ارثی است. در سال 1996 ، جی.ن. فدرال و همکاران ژن هموکروماتوز ارثی (HFE) را شناسایی کرد ، جهش هایی که بیشتر آنها منجر به پیشرفت این بیماری می شود. در سالهای 2000-2004 جهش ژنهای دیگر که منجر به ایجاد هموکروماتوز می شوند شرح داده شده است.
شیوع این بیماری از 1: 250 فرد ساكن در شمال اروپا تا 1: 3300 در بین سیاه پوستان آمریكا و كشورهای آفریقا متغیر است. این بیماری در مردان 5-10 بار بیشتر از زنان تشخیص داده می شود. در طول غربالگری ژنتیکی مشخص شد که یک جهش هموزیگوت از ژن HFE در 1 از 500 بیمار معاینه تشخیص داده می شود ، در حالی که تعداد موارد بالینی ایجاد شده از NG 1: 5،000 است ، بنابراین تعداد قابل توجهی از موارد بیماری دیر تشخیص داده نمی شود و یا در مرحله آسیب های جبران ناپذیر داخلی تشخیص داده می شود. اندام ها (سیروز ، دیابت قندی ، کاردیومیوپاتی گشاد شده).
مطابق با اساس ژنتیکی بیماری ، 4 نوع هموکروماتوز ارثی تشخیص داده می شوند:
نوع I - به واسطه جهش در ژن HFE واقع در کروموزوم 6 توسط یک مکانیسم مغلوب اتوزومال به ارث رسیده است. در اکثر موارد (در 87-90 of از بیماران) جهش C282Y ثبت می شود - جایگزینی سیستئین با تیروزین در اسید آمینه 282. جهش H63D کمتر متداول است - جایگزینی سیتیدین با گوانین در اسید آمینه 63 ،
نوع دوم - هموکروماتوز نوجوان نادر است ، به دلیل جهش در ژن مسئول سنتز پروتئین دیگر متابولیسم آهن - هپسیدین ،
نوع III - اساس ژنتیکی شامل جهش های یک ژن سنتز گیرنده ترانسفرین کد کننده ،
نوع IV - اساس ژنتیکی شامل جهش هایی در ژن SLC40A1 است که سنتز پروتئین حمل و نقل فروپورتین را رمزگذاری می کند.
علت و پاتوژنز
آهن یک جزء ضروری بیوشیمیایی از مهمترین فرآیندهای متابولیکی است ، از یک طرف ، و یک عنصر بالقوه سمی است که از طرف دیگر می تواند باعث آسیب اکسیداتیو به غشاهای بیولوژیکی ، پروتئین ها و اسیدهای نوکلئیک شود. مطابق با این ، هموستاز آهن در بدن انسان به شدت تنظیم می شود. بیشتر این عنصر تحت فرآیند بازیافت قرار می گیرد: ماکروفاژهای طحال و ضبط کبد و از بین بردن گلبول های قرمز پیر ، تخریب هموگلوبین و آزاد شدن آهن را انجام می دهد ، که به ترانسفرین یا فریتین متصل می شود و بازیافت می شود. از دست دادن فیزیولوژیکی روزانه آهن بیش از 1-2 میلی گرم نیست و با جذب مقدار معادل آهن در دستگاه گوارش جبران می شود. هیچ مکانیسمی وجود ندارد که بتواند آهن را در بدن کنترل کند.
جهش در ژنهای مسئول سنتز پروتئین های درگیر در متابولیسم آهن منجر به عدم تعادل بین جذب و از بین رفتن آهن ، تجمع پاتولوژیک این عنصر در اندام ها و بافت ها و ظهور آهن آزاد (همراه با ترانسفرین) در خون نمی شود. توسعه هموکروماتوز نوع I با جهش ژن مسئول سنتز پروتئین HFE (پروتئین هموکروماتوز) ، که یک گلیکوپروتئین (MM = 37.235 دالتون) است ، از نظر ساختاری مشابه پروتئین های کمپلکس اصلی سازگاری بافتی کلاس 1 است. عملکرد پروتئین HFE در متابولیسم آهن و مکانیسم افزایش شدید جذب آهن هنگام جهش در ژن HFE به طور کامل مشخص نشده است.
پاتوژنز هموکروماتوز نوع II-IV با جهش ژنهایی که پروتئین های دیگر درگیر در متابولیسم آهن را درگیر می کنند همراه است - هپسیدین ، گیرنده ترانسفرین-II ، فروپورتین.
یک ویژگی متمایز از نوع IV NG که مبتنی بر جهش ژن فروپورتین است ، نقض غالب فرآیندهای بازیافت آهن است که از نظر فنوتیپی خود را به عنوان کم خونی عمیق هیپوکرومیک و اریتروپوئیزیس کمبود آهن در ترکیب با هموکروماتوز شدید اندام های داخلی نشان می دهد.
تجمع پاتولوژیک آهن در اندامهای پارانشیمی با تغییرات دژنراتیو در پارانشیم سلولی و پیشرفت مترقی بافت فیبری همراه است که منجر به اختلال برگشت ناپذیر اندامهای حیاتی می شود. آسیب پذیرترین اندامهای هدف کبد ، قلب و لوزالمعده هستند.
علائم و نشانه های بالینی
تصویر بالینی NG با میزان تجمع آهن در اندام ها و بافت ها مشخص می شود. با فشارخون نوع I ، تظاهرات بالینی معمولاً در سن 45-50 سال و بالاتر مشاهده می شود. در هموکروماتوز نوجوانان (نوع II) ضایعات شدید کبدی و قلبی در اوایل ظاهر می شود - در دهه دوم یا سوم زندگی. در مردان ، تظاهرات بالینی این بیماری 3 بار بیشتر از زنان مشاهده می شود ، که با خصوصیات فیزیولوژیکی بدن زن همراه است. تظاهرات بالینی اصلی شامل علائم آسیب به کبد ، قلب ، اندام های سیستم غدد درون ریز و مفاصل است.
 علائم آسیب کبدی را می توان در یک معاینه تصادفی به شکل افزایش بی تحرک در ترانس آمینازها یا اولین با علائم فشار خون پورتال تشخیص داد: آسیت ، هپاتوسپلنومگالی ، خونریزی از واریس و مری و معده.
علائم آسیب کبدی را می توان در یک معاینه تصادفی به شکل افزایش بی تحرک در ترانس آمینازها یا اولین با علائم فشار خون پورتال تشخیص داد: آسیت ، هپاتوسپلنومگالی ، خونریزی از واریس و مری و معده.
علائم آسیب قلبی شامل حملات قلبی ، ایجاد آریتمی و علائم نارسایی قلبی است. کاردیومیوپاتی شدید عامل اصلی مرگ و میر در بیماران جوان است.
ایجاد دیابت و اختلال عملکرد غده دستگاه تناسلی از علائم برجسته NG است. در مردان ، آتروفی بیضه ، کاهش فشار جنسی ، ناتوانی جنسی ، آزواسپرمی مشاهده می شود ، در زنان - آمنوره ، ناباروری.
آسیب به مفاصل با ورم مفاصل مداوم آشکار می شود ، مفاصل متاکارپوفالانژال اغلب درگیر می شوند ، در اغلب موارد مفاصل زانو ، لگن و آرنج. سفتی مفاصل به تدریج ایجاد می شود.
از دیگر علائم بالینی NG می توان به ضعف قابل توجه و بدون تحرک ، خستگی ، خواب آلودگی ، دردهای شکمی با شدت و محل موضع گیری ، افزایش فشار خون و تمایل به عفونت های مختلف اشاره کرد (از جمله میکروارگانیسم هایی که به ندرت روی افراد سالم اثر می گذارند - Yersenia enterocolitica و Vibrio vulnificus).
تشخیص NG بر اساس یک تصویر مشخصه بالینی و آزمایشگاهی مشخص می شود.به راحتی می توان در تشخیص بیماری هموکروماتوز در بیمار مبتلا به ترکیبی از علائم زیر شک کرد: آرتروالژی ، درد شکم ، پوست برنز خاکستری ، وجود دیابت قندی و هپاتومگالی.
آزمایش خون: ترکیبی از سطح هموگلوبین بالا با غلظت هموگلوبین کم در گلبول های قرمز (MCH) مشخصه است. پیشرفت کم خونی یا سیتوپنی دیگر در مراحل اواخر بیماری مشاهده می شود - در بیماران مبتلا به سیروز کبدی یا نتیجه خونریزی بیشماری است.
مطالعه متابولیسم آهن برای شناسایی علائم آزمایشگاهی اضافه سنگ آهن لازم است و شامل تعیین سطح آهن ، فریتین و ترانسفرین سرم خون ، ظرفیت اتصال کل آهن به سرم (OZHSS) و ضریب اشباع برآورد شده ترانسفرین آهن (NTZH) می باشد. NG با افزایش سطح آهن و فریتین سرم ، کاهش سطح OGSS و ترانسفرین مشخص می شود. علائم مهم آزمایشگاهی هموکروماتوز افزایش ضریب STI در مردان بالای 60٪ ، در زنان - بالای 50٪ است.
تست desferal وجود اضافه بار آهن را تأیید می کند: پس از 5/0 گرم عضله ای دفروکسامین (دسفال) ، دفع روزانه آهن در ادرار به طور قابل توجهی از حد طبیعی (0-5 میلی مول در روز) فراتر می رود.
در نوع IV NG ، آزمایشگاه می تواند با کم خونی عمیق هیپوکروم ، هیپوسیدیرینمی و فریتین سرم بالا نشان داده شود ، که با اضافه بار شدید بافت با آهن همراه است.
انجام آنالیز ژنتیکی مولکولی به شما اجازه می دهد تا ماهیت ارثی هموکروماتوز را تأیید کرده و ماهیت ثانویه اضافه بار آهن را نیز از بین ببرید. تشخيص NG با حضور جهش هاي هموزي ژن ژن HFE (C282Y يا H63D) يا زماني كه هتروزيگوت هاي پيچيده (تركيب جهش هاي هتروزيگوت C282Y و H63D) در بيماران با علائم آزمايشگاهي اضافه بار آهن تشخيص داده مي شود. جهش های هتروزیگوت جدا شده C282Y و H63D در جمعیت افراد سالم با فرکانس 10/10٪ و 4/23٪ موارد مشاهده می شود ، به ترتیب ، وجود این جهش ها پایه ای برای تشخیص NG نیست.
سی تی اسکن اندام های شکمی افزایش تراکم بافت کبد به دلیل رسوبات آهن را نشان می دهد و اجازه می دهد وجود هموکروماتوز مشکوک شود.
با MRI کبد بیمار مبتلا به هموکروماتوز دارای رنگ خاکستری تیره یا سیاه است. CT و MRI کبد برای رد تشخیص کارسینوم سلولهای کبدی ضروری است.
بیوپسی کبد با تعیین نیمه کمی یا کمی از مقدار آهن به شما امکان می دهد میزان رشد فیبروز و غلظت آهن در بافت کبد را تعیین کنید. برای تشخیص هموکروماتوز ، توصیه می شود "شاخص آهن کبدی" که برابر است با میزان آهن در بافت کبد (با وزن خشک میکرومول / گرم) با سن بیمار (در سالها) محاسبه شود. شاخص> 2.0 تشخیص NG را تأیید می کند.
هموکروماتوز ارثی باید با سندرمهای اضافه بار آهن ثانویه ، که در بیماران مبتلا به کم خونی همولیتیک ارثی و اکتسابی ایجاد می شود ، تمایز یابد ، برخی از اشکال سندرم میلوسیپلاستیک (کم خونی سایدوبلاستیک نسوز) ، پورفیری و همچنین در بیماران مبتلا به آسیب کبدی الکلی.
هدف از درمان NG از بین بردن آهن اضافی از بدن و جلوگیری از صدمه برگشت ناپذیر به اندام های داخلی است. یک روش درمانی معمول خون ریزی است. دوره اولیه شامل خونریزی در حجم 500 میلی لیتر یک بار در هفته است. پس از پایین آمدن سطح هموگلوبین توسط 15-20 گرم در لیتر ، سطح MCV 5 تا 5 fl. و محتوای فریتین سرم تا 50-50 نانوگرم در میلی لیتر ، به درمان نگهدارنده بروید - از بین بردن 500 میلی لیتر خون هر 2-4 ماه در مردان و هر 3-6 ماه در زنان. درمان مادام العمر است.
در صورت کم خونی یا سایر موارد منع مصرف (به عنوان مثال نارسایی قلبی) ، از واسطه آهن برای خون ریزی استفاده می شود. دفروكسامین آهن اضافی را در بافت ها و سرم خون متصل می كند و با ادرار و مدفوع دفع می كند. با این حال ، نیمه عمر این دارو کوتاه است - فقط 10 دقیقه ، که نیاز به تجویز آهسته دارد: به صورت داخل وریدی به صورت تزریق 3-4 ساعته یا به صورت زیر جلدی ، ترجیحا به صورت تزریق 12 ساعته یا شبانه روزی با استفاده از پمپ های مخصوص. داروهای جدید تشکیل دهنده مجتمع برای تجویز خوراکی ایجاد شده و در مرحله مطالعه یا اجرای کلینیکی قرار دارند که مؤثرترین آنها Deferasirox است.
اثربخشی درمان با پویایی داده های بالینی و آزمایشگاهی مشخص می شود. وضعیت بیماران بعد از یک دوره خون ریزی بهبود می یابد: ضعف ، خستگی ، خواب آلودگی از بین می رود ، اندازه کبد کاهش می یابد ، دوره دیابت و کاردیومیوپاتی می تواند بهبود یابد. کنترل آزمایشگاهی شامل مطالعه هموگرافی ، شاخصهای فریتین ، آهن و NTZH (1 بار در 3 ماه) ، میزان دفع آهن ادرار است.
در صورت تشخیص زودرس فشار خون بالا و خونرسانی به موقع درمانی ، پیش آگهی مطلوب است: امید به زندگی بیماران با امید به زندگی افرادی که از هموکروماتوز رنج نمی برند ، فرق نمی کند. در موارد دیر تشخیص بیماری ، در صورت وجود سیروز کبدی ، کاردیومیوپاتی ، دیابت قندی ، پیش بینی بیماری با شدت این عوارض غیر قابل برگشت تعیین می شود. علل اصلی مرگ و میر بیماران عبارتند از: عوارض دیابت ، نارسایی قلبی ، سرطان اولیه کبد ، نارسایی کبد ، خونریزی از واریس مری و معده ، عفونت همزمان.
اطلاعات عمومی
هموکروماتوز (دیابت برنز ، سیروز رنگدانه) یک نقض ژنتیکی متابولیسم آهن است و منجر به رسوب رنگدانه های حاوی آهن در بافت ها و اندام ها و ایجاد نارسایی اندام های متعدد می شود. این بیماری که همراه با یک مجموعه علائم مشخصه (رنگدانه های پوستی ، سیروز کبدی و دیابت قندی) در سال 1871 شرح داده شد ، و در سال 1889 به دلیل مشخصه رنگ پوست و اندام های داخلی به آن هموکروماتوز گفته شد. فراوانی هموکروماتوز ارثی در یک جمعیت 1.5-3 مورد در هر 1000 جمعیت است. مردان 2-3 برابر بیشتر از خانمها از هموکروماتوز رنج می برند. سن متوسط رشد پاتولوژی 60-40 سال است. با توجه به ماهیت پلی سیستماتیک ضایعه ، رشته های مختلف بالینی در مطالعه هموکروماتوز نقش دارند: دستگاه گوارش ، قلب و عروق ، غدد درون ریز ، روماتولوژی و غیره.
از نظر اتیولوژیک ، هموکروماتوز اولیه (ارثی) و ثانویه متمایز می شوند. هموکروماتوز اولیه با نقص در سیستم های آنزیمی همراه است و منجر به رسوب آهن در اندام های داخلی می شود. بسته به نقص ژن و تصویر بالینی ، 4 شکل از هموکروماتوز ارثی متمایز می شوند:
- من - اتوزومال کلاسیک مغلوب ، نوع HFE مرتبط (بیش از 95٪ موارد)
- II - نوع نوجوان
- III - نوع جدا نشده HFE ارثی (جهش در گیرنده ترانسفرین نوع 2)
- IV- نوع غالب اتوزومال.
هموکروماتوز ثانویه (hemosiderosis عمومی) در نتیجه کمبود اکتسابی سیستم های آنزیمی درگیر در متابولیسم آهن ایجاد می شود و اغلب با بیماری های دیگر همراه است ، در ارتباط با آنها انواع زیر آن متمایز می شود: پس از انتقال خون ، تغذیه ای ، متابولیکی ، مختلط و نوزادی.
در دوره بالینی ، هموکروماتوز 3 مرحله را طی می کند: I - بدون اضافه بار آهن ، II - با اضافه بار آهن ، اما بدون علائم بالینی ، III - با پیشرفت تظاهرات بالینی.

علل هموکروماتوز
هموکروماتوز ارثی اولیه یک اختلال انتقال اتوزومال مغلوب است. این مبتنی بر جهش ژن HFE است که در بازوی کوتاه کروموزوم 6 قرار دارد. نقص در ژن HFE منجر به اختلال در جذب واسطه ترانسفرین از آهن توسط سلولهای اثنی عشر 12 و در نتیجه ایجاد سیگنال دروغین در مورد کمبود آهن در بدن می شود. به نوبه خود ، این به افزایش سنتز پروتئین اتصال دهنده DCT-1 توسط انتروسیت ها و افزایش جذب آهن در روده (با مصرف طبیعی عناصر کمیاب از مواد غذایی) کمک می کند. در آینده ، رسوب بیش از حد رنگدانه حاوی آهن هموسیدین در بسیاری از اندامهای داخلی وجود دارد ، مرگ عناصر عملکردی فعال آنها با پیشرفت فرآیندهای اسکلروتیک. با هموکروماتوز ، 0.5-1.0 گرم آهن سالانه در بدن انسان جمع می شود و با رسیدن سطح کل آهن 20 گرم (گاهی اوقات 40-50 گرم یا بیشتر) تظاهرات بیماری تجدید می شود.
هموکروماتوز ثانویه به دلیل نتیجه بیش از حد اگزوژن آهن در بدن ایجاد می شود. این بیماری می تواند با انتقال خون مکرر مکرر ، مصرف بی رویه داروهای آهن ، تالاسمی ، برخی از انواع کم خونی ، پورفیری پوست ، سیروز الکلی کبد ، هپاتیت مزمن ویروسی B و C ، نئوپلاسم های بدخیم ، به دنبال رژیم غذایی کم پروتئین رخ دهد.
علائم هموکروماتوز
تظاهرات بالینی هموکروماتوز ارثی در بزرگسالی اتفاق می افتد ، هنگامی که کل آهن آهن در بدن به مقادیر حساس (40-40 گرم) برسد. بسته به سندرم های غالب ، هپاتوپاتی (هموکروماتوز کبد) ، قلب و عروق (هموکروماتوز قلبی) ، فرم های غدد درون ریز بیماری از هم متمایز می شوند.
این بیماری به تدریج گسترش می یابد ، در مرحله اولیه شکایات غیر اختصاصی در مورد افزایش خستگی ، ضعف ، کاهش وزن ، کاهش میل جنسی غالب است. در این مرحله ممکن است بیماران به دلیل کندروکلسینوز مفاصل بزرگ به دلیل درد در هیپوکندریوم راست ، خشکی پوست ، ورم مفاصل دچار اختلال شوند. در مرحله گسترش یافته هموکروماتوز ، یک مجموعه علائم کلاسیک تشکیل می شود ، که با رنگدانه های پوستی (پوست برنز) ، سیروز ، دیابت قندی ، کاردیومیوپاتی ، هیپوگونادیسم نمایان می شود.
معمولاً اولین علامت هموکروماتوز ظاهر رنگ خاصی از پوست و غشاهای مخاطی است که عمدتا در صورت ، گردن ، اندام فوقانی ، در زیر بغل و دستگاه تناسلی خارجی و زخمهای پوستی بیان می شود. شدت رنگدانه بستگی به مدت دوره بیماری دارد و از خاکستری کم رنگ (دودی) تا برنز-قهوه ای متفاوت است. مشخصه ریزش مو روی سر و تنه ، تغییر شکل مقعر (قاشق شکل) ناخن ها است. آرتروپاتی مفاصل متاکارپوفالانژال ، گاهی اوقات زانو ، لگن و آرنج با پیشرفت بعدی سفتی آنها ذکر می شود.
تقریباً در کلیه بیماران ، افزایش کبد ، طحال ، طحال و سیروز کبد تشخیص داده می شود. عملکرد پانکراس در ایجاد دیابت وابسته به انسولین بیان شده است. در نتیجه آسیب غده هیپوفیز در هنگام هموکروماتوز ، عملکرد جنسی رنج می برد: در مردان ، آتروفی بیضه ، ناتوانی جنسی ، ژنیکوماستی ، در زنان - آمنوره و ناباروری. هموکروماتوز قلب با کاردیومیوپاتی و عوارض آن مشخص می شود - آریتمی ، نارسایی مزمن قلب ، انفارکتوس میوکارد.
در مرحله پایانی هموکروماتوز ، فشارخون پورتال ، آسیت ، کاشیکسی ایجاد می شود. مرگ بیماران معمولاً در نتیجه خونریزی از واریس مری ، نارسایی کبد ، نارسایی حاد قلبی ، کما دیابتی ، پریتونیت آسپتیک ، سپسیس اتفاق می افتد. هموکروماتوز به طور قابل توجهی خطر ابتلا به سرطان کبد (کارسینوم کبدی) را افزایش می دهد.
تشخیص هموکروماتوز
بسته به علائم غالب ، بیماران مبتلا به هموکروماتوز ممکن است از متخصصان مختلفی درخواست کنند: متخصص گوارش ، قلب و عروق ، غدد درون ریز ، متخصص زنان ، ارولوژی ، روماتولوژیست و متخصص پوست. در همین حال ، تشخیص بیماری برای انواع مختلف بالینی هموکروماتوز یکسان است. پس از ارزیابی علائم بالینی ، به بیماران مجموعه ای از مطالعات آزمایشگاهی و ابزار برای تأیید صحت تشخیص داده می شود.
معیارهای آزمایشگاهی برای هموکروماتوز افزایش قابل توجهی در سطح آهن ، فریتین و ترانسفرین در سرم خون ، افزایش دفع آهن در ادرار و کاهش در کل توانایی اتصال چربی آهن سرم خون است. این تشخیص با بیوپسی سوراخ کبد یا پوست تأیید می شود ، در نمونه هایی که رسوب هموسیدرین تشخیص داده می شود. ماهیت ارثی هموکروماتوز در نتیجه تشخیص ژنتیکی مولکولی ایجاد می شود.
به منظور ارزیابی شدت آسیب به اندام های داخلی و پیش آگهی بیماری ، آزمایش های کبدی ، سطح گلوکز خون و ادرار ، هموگلوبین گلیکوزیله شده و غیره مورد بررسی قرار می گیرد.تشخیص آزمایشگاهی از هموکروماتوز با انجام مطالعات ابزاری: رادیوگرافی مفصل ، ECG ، اکوکاردیوگرافی ، سونوگرافی حفره شکمی ، MRI کبد و غیره انجام می شود.
درمان هموکروماتوز
هدف اصلی درمان از بین بردن آهن اضافی از بدن و جلوگیری از بروز عوارض است. بیماران مبتلا به هموکروماتوز رژیم غذایی تجویز می کنند که غذاهای سرشار از آهن (سیب ، گوشت ، جگر ، گندم سیاه ، اسفناج و غیره) ، کربوهیدرات های قابل هضم را محدود می کند. مصرف مولتی ویتامین ها ، اسید اسکوربیک ، مکمل های غذایی حاوی آهن ، الکل ممنوع است. برای از بین بردن آهن اضافی بدن ، آنها به کنترل خون تحت کنترل هموگلوبین ، هماتوکریت و فریتین متوسل می شوند. برای این منظور می توان از روشهای هموکروژانس خارج سلولی استفاده کرد - پلاسمافیزیس ، خونریزی ، سیتافرزی.
درمان دارویی پاتوژنتیک هموکروماتوز مبتنی بر تجویز عضلانی یا داخل وریدی یونهای Fe3 + به دفروکسامین است که به بیمار وصل می شود. در عین حال ، درمان علامتی سیروز کبدی ، نارسایی قلبی ، دیابت قندی و هیپوگنادیسم انجام می شود. با آرتروپاتی شدید ، نشانه هایی برای آرتروپلاستی (آندوپروستیستیک مفاصل آسیب دیده) مشخص می شود. در بیماران مبتلا به سیروز ، موضوع پیوند کبد مورد بررسی قرار می گیرد.
پیش بینی و پیشگیری از هموکروماتوز
با وجود روند پیشرفت بیماری ، درمان به موقع می تواند عمر بیماران مبتلا به هموکروماتوز را برای چند دهه طولانی کند. در صورت عدم درمان ، میانگین امید به زندگی بیماران پس از تشخیص پاتولوژی از 4-5 سال تجاوز نمی کند. وجود عوارض هموکروماتوز (عمدتا سیروز کبد و نارسایی احتقانی قلب) یک علامت پیش آگهی نامطلوب است.
با هموکروماتوز ارثی ، پیشگیری به غربالگری خانواده ، تشخیص زودرس و درمان بیماری منجر می شود. تغذیه منطقی ، نظارت بر تجویز و تجویز آماده سازی آهن ، تزریق خون ، امتناع از نوشیدن الکل و نظارت بر بیماران مبتلا به بیماریهای کبدی و سیستم خونی باعث جلوگیری از ایجاد هموکروماتوز ثانویه می شود.