بیوسنتز کلسترول و بیوشیمی آن - دیابت
بدون شک ، کلسترول بهترین لیپید شناخته شده برای عموم است ؛ به دلیل همبستگی زیاد بین کلسترول خون بالا و فراوانی بیماری های قلبی و عروقی بدن بدنام است. کمتر به نقش اساسی کلسترول به عنوان یکی از اجزای غشای سلولی و به عنوان پیشرو هورمونهای استروئیدی و اسیدهای صفراوی توجه کمتری شده است. کلسترول برای بسیاری از حیوانات از جمله انسان لازم است ، اما حضور آن در غذاهای پستانداران اختیاری است - سلول های بدن خود می توانند آن را از پیش سازهای ساده سنتز کنند.
ساختار این ترکیب 27 کربنی مسیر پیچیده ای را برای بیوسنتز آن نشان می دهد ، اما تمام اتم های کربن آن توسط یک پیش ساز منفرد - استات - تهیه می شود. بلوک ایزوپرن - مهمترین واسطه ها از استات گرفته تا کلسترول ، آنها پیش ساز بسیاری از لیپیدهای طبیعی هستند و مکانیسم هایی که پلیمرزه شده در آن از بلوک ایزوپرن استفاده می شود ، در تمام مسیرهای متابولیکی مشابه هستند.
ما با بررسی مراحل اصلی در مسیر بیوسنتز کلسترول از استات شروع می کنیم ، سپس در مورد حمل و نقل کلسترول از طریق جریان خون ، جذب آن توسط سلول ها ، تنظیم طبیعی سنتز کلسترول و تنظیم در موارد اختلال در جذب یا حمل و نقل بحث می کنیم. سپس به مواد دیگری که از کلسترول خون هستند مانند اسیدهای صفراوی و هورمونهای استروئیدی نگاه می کنیم. سرانجام ، شرح مسیرهای بیوسنتز برای تشکیل بسیاری از ترکیبات - مشتقات بلوک ایزوپرن ، که در آن مراحل اولیه مشترک با سنتز کلسترول وجود دارد ، تطبیق پذیری فوق العاده ای از تراکم ایزوپرنوئید در بیوسنتز را نشان می دهد.
کلسترول از استیل CoA در چهار مرحله تولید می شود
کلسترول ، مانند اسیدهای چرب زنجیره ای بلند ، از استیل CoA ساخته می شود ، اما الگوی مونتاژ کاملاً متفاوت است. در آزمایشات اول ، استات با 14 درجه سانتیگراد یا در اتم کربن متیل یا کربوکسیل به خوراک حیوانات اضافه شد. بر اساس توزیع برچسب در کلسترول جدا شده از دو گروه از حیوانات (شکل 21-32) ، مراحل آنزیمی بیوسنتز کلسترول شرح داده شد.
شکل 21-32. منبع اتمهای کربن کلسترول. در طی آزمایشات با استفاده از استات رادیواکتیو با برچسب متیل کربن (سیاه) یا کربن کربوکسیل (قرمز) مشخص شد. در ساختار تغلیظ شده ، حلقه ها با حروف A تا D مشخص می شوند.

سنتز در چهار مرحله انجام می شود ، همانطور که در شکل نشان داده شده است. 21-33: (1) تراکم سه باقیمانده استات برای تشکیل یک واسطه شش کربن از موالونات ، (2) تبدیل میوونونات به بلوک ایزوپرن فعال ، (3) پلیمریزاسیون شش واحد ایزوپرن پنج کربن برای تشکیل یک اسکالن خطی 30 کربن ، (4) چرخه اسکلن به شکل چهار حلقه از هسته استروئید ، و به دنبال آن یک سری از تغییرات (اکسیداسیون ، حذف یا مهاجرت گروه های متیل) با تشکیل کلسترول.
شکل 21-33 تصویر کلی از بیوسنتز کلسترول. چهار مرحله از سنتز در متن مورد بحث قرار گرفته است. بلوک های ایزوپرن موجود در اسکالن توسط خطوط متراکم قرمز مشخص شده اند.

مرحله (1) سنتز موالونات از استات. مرحله اول بیوسنتز کلسترول منجر به تشکیل یک محصول میانی می شود تقارن (شکل 21-34). دو مولکول استیل CoA برای دادن استواستیل CoA متراکم شده ، که با سومین مولکول استیل CoA متراکم می شوند تا یک ترکیب شش کربنی تشکیل دهند. β-هیدروکسی-β-متیلگلوتاریل-CoA (HM G -CoA). این دو واکنش اول کاتالیز می شوند تیولاز و به ترتیب NMG-CoA synthase. سیتوزولی NM G-CoA سنتاز این مسیر متابولیکی با ایزوآنزیم میتوکندری متفاوت است ، که باعث سنتز NMG-CoA در هنگام تشکیل اجسام کتون می شود (شکل 17-18).
شکل 21-34 تشکیل موالونات از استیل CoA. منبع موالونات C-1 و C-2 از استیل-CoA به رنگ صورتی برجسته است.

واکنش سوم سرعت کل فرایند را محدود می کند. در آن ، NMG-CoA به موالونات کاهش می یابد ، که برای آن هر یک از دو مولکول NA D PH دو الکترون فراهم می کند. ردوکتاز HMG-CoA - پروتئین غشایی انتگرال از ER صاف ، همانطور که بعداً خواهیم دید ، به عنوان اصلی ترین تنظیم مسیر سوخت و ساز بدن تشکیل کلسترول ، خدمت می کند.
مرحله (2) تبدیل موالونات به دو ایزوپرن فعال شده است. در مرحله بعدی سنتز کلسترول ، سه گروه فسفات از مولکولهای ATP به موالونات منتقل می شوند (شکل 21-35). فسفات متصل به گروه هیدروکسیل در mevalonate C-3 در واسطه 3-فسفو-5-پیروفسفوموالونات یک گروه ترک خوب است ، در مرحله بعدی هر دو این فسفات ها و گروه کربوکسیل مجاور ترک می کنند ، تشکیل یک پیوند مضاعف در محصول پنج کربن ∆ 3 -ایزوپنتنیل پیروفسفات. این اولین دو مورد از ایزوپرن فعال است - شرکت کنندگان اصلی در سنتز کلسترول. ایزومره سازی Δ3-isopentenylpyrophosphate یک ایزوپرن فعال شده دوم می دهد دی متیلالیل پیروفسفات. سنتز ایزوپنتنیل پیروفسفات در سیتوپلاسم سلولهای گیاهی مطابق مسیری که در اینجا شرح داده می شود اتفاق می افتد. با این حال ، کلروپلاستهای گیاهی و بسیاری از باکتریها از مسیری مستقل از موالونات استفاده می کنند. این مسیر جایگزین در حیوانات یافت نمی شود ، بنابراین هنگام ایجاد آنتی بیوتیک های جدید جذاب است.
شکل 21-35 تبدیل موالونات به بلوک ایزوپرن فعال شده. شش واحد فعال شده برای تشکیل اسکالن ترکیب می شوند (شکل 21-36 را ببینید). گروه های ترکیبی 3-فسفو -5-پیروفسفوموالونات به رنگ صورتی برجسته می شوند. در براکت های مربع یک واسطه فرضی است.

مرحله (3) تراکم شش واحد ایزوپرن فعال شده برای تشکیل اسکالن. ایزوپنتنیل پیروفسفات و پیروفسفات دی متیلالیل در حال حاضر تحت تراکم سر به دم ، که در آن یک گروه پیرو فسفات حرکت می کند و یک زنجیره 10 کربنی تشکیل می دهد - ژیرانیل پیروفسفات (شکل 21-36). (پیرو فسفات به سر متصل می شود.) پیران فسفات گرانیل تحت عنوان تراکم سر تا دم زیر با ایزوپنتنیل پیروفسفات و فرم های متوسط 15 کربنی قرار می گیرد. فارنسیل پیروفسفات. سرانجام ، دو مولکول فارنسیل پیرو فسفات "سر به سر" ترکیب می شوند ، هر دو گروه فسفات برداشته می شوند - تشکیل می شوند اسکالن
شکل 21-36 تشکیل اسکالن. یک ساختار اسکالن حاوی 30 اتم کربن در طی تراکم های پی در پی فعال شده توسط بلوک های ایزوپرن (پنج کربن) فعال می شود.

نامهای متداول این واسطه ها از نام منابعی که از آنها برای اولین بار جدا شده اند گرفته شده است. Geraniol ، یک جزء روغن گل سرخ ، دارای عطر و طعم شمعدانی است و فارنسول ، که در رنگ های اقاقیا فارنسا یافت می شود ، یک لیلی از عطر دره دارد. بسیاری از بوهای طبیعی گیاهان متعلق به ترکیباتی هستند که از بلوک ایزوپرن ساخته شده اند. اسکالن ، که برای اولین بار از کبد کوسه جدا شده است (گونه های اسکوالوس) ، از 30 اتم کربن تشکیل شده است: 24 اتم در زنجیره اصلی و شش اتم در جایگزین های فلزی.
مرحله (4) تبدیل اسکالن به چهار حلقه هسته استروئیدی. در شکل 21-37 به وضوح دیده می شود که ساختار زنجیره اسکالن ، و استرول ها - چرخه ای. تمام استرول ها چهار حلقه متراکم دارند که هسته استروئید را تشکیل می دهند و همه آنها الکلی با گروه هیدروکسیل در اتم C-3 هستند ، از این رو نام انگلیسی استرول است. تحت عمل مونوكسیژناز اسكالن یک اتم اکسیژن از O به انتهای زنجیره اسکالن اضافه می شود 2 و اپوکسید تشکیل می شود. این آنزیم یکی دیگر از عملکردهای مخلوط اکسیداز است (اضافه کردن 21-1) ، NADPH اتم اکسیژن دیگری را از O کاهش می دهد 2 به ح2 ا. اتصال دوتایی محصول اسکالن-2،3-اپوکسید به گونه ای ترتیب داده شده است که یک واکنش قابل ملاحظه ای سازگار بتواند زنجیره ای از اپوکسید اسکالن را به یک ساختار چرخه ای تبدیل کند. در سلولهای حیوانی ، این چرخه کوهی منجر می شود لانوسترول که شامل چهار حلقه مشخصه هسته استروئید است. در نتیجه ، لانوسترول از طریق یک سری تقریباً 20 واکنش به کلسترول تبدیل می شود که شامل مهاجرت برخی از گروه های فلزی و از بین بردن سایرین است. شرح این مسیر شگفت انگیز بیوسنتز ، که یکی از دشوارترین آنهاست ، توسط کنراد بلوچ ، تئودور لینن ، جان کرنفورت و جورج پوپیاک در اواخر دهه 50 ساخته شد.
شکل 21-37 بسته شدن حلقه ، اسكالن خطي را به يك هسته استروئيدي تغيير يافته مبدل مي كند. مرحله اول توسط یک اکسیداز با یک عملکرد مختلط (مونوکسیژناز) ، که کیهان بستر N AD PH کاتالیز می شود. محصول اپوکسید است که در مرحله بعدی برای تشکیل یک هسته استروئید چرخه ای می کند. محصول نهایی این واکنش ها در سلول های حیوانی کلسترول است ؛ در موجودات دیگر استرول ها کمی متفاوت از آن تشکیل می شوند.


کلسترول یکی از مشخصه های استرول سلول های حیوانی است ، گیاهان ، قارچ ها و پروتئین ها استرول های بسیار مشابه دیگری تولید می کنند.
آنها از همان مسیر سنتز به اسکالن-2،3-اپوکسید استفاده می کنند ، اما سپس این مسیرها کمی واگرا می شوند و سایر استرول ها شکل می گیرند ، مانند سیگماسترول در بسیاری از گیاهان و ارگسترول در قارچ ها (شکل 21-37).
مثال 21-1 هزینه های انرژی برای سنتز اسکوالن
هزینه های انرژی (به عنوان مولکول ATP بیان شده) برای سنتز یک مولکول اسکارالن چقدر است؟
راه حل در سنتز اسکالن از استیل-CoA ، ATP فقط در مرحله ای انجام می شود که موالونات به یک پیش سازنده اسکالن ایزوپرن فعال تبدیل می شود. شش مولکول ایزوپرن فعال برای ساختن یک مولکول اسکارالن لازم است و برای تولید هر مولکول فعال ، سه مولکول ATP لازم است. در کل ، 18 مولکول ATP صرف سنتز یک مولکول اسکالن می شود.
ترکیبات کلسترول در بدن
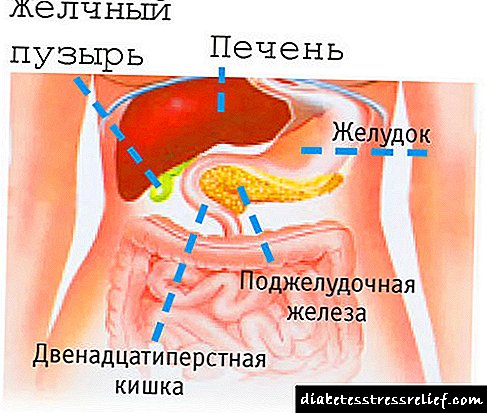
در مهره داران ، مقدار زیادی کلسترول در کبد سنتز می شود. برخی از کلسترول سنتز شده در غشاء سلولهای کبدی گنجانیده شده است ، اما به طور عمده در یکی از سه شکل آن صادر می شود: کلسترول صفراوی (صفراوی) ، اسیدهای صفراوی یا استرهای کلسترول. اسیدهای صفراوی و نمکهای آنها مشتقات هیدروفیل کلسترول هستند که در کبد سنتز می شوند و در هضم لیپیدها نقش دارند (شکل 17-1). استرهای کلسترول با عمل بوجود آمده در کبد acyl-CoA- کلسترول- acyltransferase (ACAT). این آنزیم انتقال یک مانده اسید چرب از کوآنزیم A به گروه هیدروکسیل کلسترول را کاتالیز می کند (شکل 21-38) و کلسترول را به صورت آبگریز تر تبدیل می کند. استرهای کلسترول موجود در ذرات لیپوپروتئین ترشح شده با استفاده از کلسترول به سلولهای دیگر منتقل شده یا در کبد ذخیره می شوند.
شکل 21-38. سنتز استرهای کلسترول. استری شدن باعث می شود کلسترول یک شکل آبگریز تر و بیشتر برای ذخیره سازی و حمل و نقل باشد.

کلسترول برای سنتز غشاها برای کلیه بافتهای موجود در حیوان در حال رشد ضروری است و برخی از اندامها (به عنوان مثال غدد فوق کلیوی و غدد جنسی) از کلسترول به عنوان پیشرو هورمونهای استروئیدی استفاده می کنند (این مورد در زیر مورد بحث قرار خواهد گرفت). کلسترول همچنین پیش ماده ویتامین D است (به شکل 10-20 ، در مقابل 1 مراجعه کنید).
کلسترول و سایر لیپیدها دارای لیپوپروتئین های پلاسما هستند
کلسترول و استرهای کلسترول ، مانند تری گلیسیرول ها و فسفولیپیدها ، عملاً در آب نامحلول هستند ، با این حال ، آنها باید از بافتی که در آن سنتز شده اند به بافتهایی که در آن ذخیره یا مصرف می شوند ، حرکت کنند. آنها توسط جریان خون به شکل لیپوپروتئین های پلاسما خون - مجتمع های ماکرومولکولی پروتئین های حامل خاص (آپولیپوپروتئین ها) با فسفولیپیدها ، کلسترول ، استرهای کلسترول و تری اسیل گلیسرول های موجود در این مجتمع ها در ترکیبات مختلف.
آپولیپوپروتئین ها ("apo" به خود پروتئین بدون چربی اشاره دارد) با لیپیدها ترکیب می شوند تا چندین بخش از ذرات لیپوپروتئین تشکیل شوند - مجتمع های کروی با لیپیدهای آبگریزی در مرکز و زنجیره های اسید آمینه آبدوست روی سطح (شکل 21-39 ، الف). با ترکیبات مختلفی از لیپیدها و پروتئین ها ، ذره هایی از تراکم های مختلف تشکیل می شوند - از شیلو میکرون ها گرفته تا لیپوپروتئین های با چگالی بالا. با استفاده از میکروسکوپ الکترونی می توان این ذرات را با استفاده از اولتراسانتریفیوژ جدا کرد و از نظر بصری مشاهده کرد (شکل 21-39 ، ب). هر بخش از لیپوپروتئین ها عملکرد خاصی را انجام می دهند ، که توسط محل سنتز ، ترکیب لیپیدها و محتوای آپولیپوپروتئین ها تعیین می شود. حداقل 10 آپولیپوپروتئین مختلف در پلاسمای خون انسان یافت شد (جدول 21-2) که در اندازه ، واکنش با آنتی بادی های خاص و توزیع مشخصه در کلاس های مختلف لیپوپروتئین ها متفاوت است. این اجزای پروتئین به عنوان ماده سیگنال دهنده ای که لیپوپروتئین ها را به سمت بافت های خاص هدایت می کند یا آنزیم های فعال کننده ای را که در لیپوپروتئین ها وجود دارد ، هدایت می کنند.
جدول 21-1. لیپوپروتئین های پلاسمایی انسان
ترکیب (کسر جرم ،٪)
r = 513،000). یک ذره از LDL حاوی یک هسته تقریباً 1500 مولکولی استرهای کلسترول است ، در اطراف هسته یک پوسته از 500 مولکول کلسترول ، 800 مولکول فسفولیپیدها و یک مولکول از apoB-100 وجود دارد. ب - چهار کلاس لیپوپروتئین ها ، قابل مشاهده با میکروسکوپ الکترونی (پس از تظاهرات منفی). در جهت عقربههای ساعت ، از شکل چپ بالا شروع می شود: کیلو میکرون ها - با قطر 50 تا 200 نانومتر ، PL O NP - از 28 تا 70 نانومتر ، HDL - از 8 تا 11 نانومتر ، و LDL - از 20 تا 55 نانومتر. خواص لیپوپروتئین ها در جدول آورده شده است. 21-2

Chylomicrons ، در Sec. 17 ، تری گلیسرول های مواد غذایی را از روده به بافت های دیگر منتقل کنید. اینها بزرگترین لیپوپروتئینها هستند ، آنها دارای کمترین تراکم و بیشترین میزان نسبی تری اسیل گلیسرول ها هستند (شکل 17-2 را ببینید). Chylomicrons در ER سلول های اپیتلیال روده کوچک را چیده می شود ، سپس از طریق سیستم لنفاوی حرکت کرده و از طریق ورید ساب کلاوی چپ وارد جریان خون می شود. آپولیپوپروتئین های Chylomicron حاوی apoB-48 (منحصر به فرد برای این کلاس از لیپوپروتئین ها) ، apoE و apoC-II (جدول 21-2). AroC-II لیپوپروتئین لیپاز را در مویرگ های بافت چربی ، قلب ، ماهیچه های اسکلتی و غده پستانی شیرده فعال می کند و جریان اسیدهای چرب آزاد را به درون این بافت ها تضمین می کند. بنابراین ، کلیومایکرونها اسیدهای چرب مواد غذایی را به بافتهایی منتقل می کنند ، که در آنجا از آنها به عنوان سوخت مصرف یا ذخیره می شوند (شکل 21-40). باقیمانده های کلیومایکرون (که عمدتا از تری گلیسرول ها آزاد می شوند ، اما هنوز حاوی کلسترول ، apoE و apoB-48 هستند) توسط جریان خون به کبد منتقل می شوند. در کبد ، گیرنده ها به apoE موجود در باقیمانده های chylomicron متصل می شوند و جذب آنها را توسط اندوسیتوز واسطه می کنند. در سلولهای کبدی ، این باقیمانده ها کلسترول موجود در آنها را آزاد کرده و در لیزوزوم ها از بین می روند.
جدول 21-2. آپولیپوپروتئینهای لیپوپروتئین پلاسما انسان
عملکرد (در صورت شناخته شدن)
L CAT را فعال می کند و با انتقال دهنده ABC تعامل دارد
مهار L CAT
L CAT ، انتقال / ترخیص کالا از کلسترول را فعال می کند
اتصال به گیرنده LDL
Chylomicrons ، VLDL ، HDL
Chylomicrons ، VLDL ، HDL
Chylomicrons ، VLDL ، HDL
ترخیص از مانده های VLDL و کایلومیکرون را شروع می کند
هنگامی که مواد غذایی حاوی اسیدهای چرب بیشتری نسبت به آن هستند که در حال حاضر می توانند به عنوان سوخت مورد استفاده قرار گیرند ، آنها به کبد تبدیل به تری اسیل گلیسرول در کبد تبدیل می شوند که با آپولیپوپروتئین های خاص کسری را تشکیل می دهند. لیپوپروتئینهای با چگالی بسیار کم (VLDL). کربوهیدراتهای بیش از حد موجود در کبد نیز می تواند به تری اسیل گلیسرولها تبدیل شده و به عنوان VLDL صادر شود (شکل 21-40 ، الف).علاوه بر تری اسیل گلیسرول ها ، بخش VLDL حاوی مقدار معینی کلسترول و استرهای کلسترول و همچنین apoB-100 ، apoC-1 ، apoC-II ، apoC III و apoE (جدول 21-2) است. این لیپوپروتئین ها همچنین از طریق خون از کبد به بافت ماهیچه ای و چربی منتقل می شوند ، که پس از فعال شدن لیپوپروتئین لیپاز توسط apo-C II ، اسیدهای چرب آزاد از تری اسیل گلیسرول های بخش VLDL آزاد می شوند. چربیها اسیدهای چرب آزاد را اسیر می کنند ، دوباره آنها را به تری اسیل گلیسرول تبدیل می کنند ، که در این سلول ها به شکل ترکیبات چربی (قطرات) ذخیره می شوند ، برعکس ، میوسیت ها بلافاصله اسیدهای چرب را اکسیده می کنند تا انرژی تولید کنند. بیشتر مانده های VLDL توسط سلولهای کبدی از گردش خون حذف می شوند. جذب آنها ، مشابه جذب کیلو میکرون ها ، توسط گیرنده ها واسطه می یابد و به حضور apoE در باقیمانده های VLDL بستگی دارد (در افزودنی 21-2 ، رابطه بین apoE و بیماری آلزایمر شرح داده شده است).
شکل 21-40 لیپوپروتئین ها و انتقال چربی ها ، و - لیپیدها توسط جریان خون به شکل لیپوپروتئین ها منتقل می شوند که با عملکردهای مختلف و ترکیب پروتئینها و لیپیدها به چندین بخش مختلف ترکیب می شوند (تب 21-1 ، 21-2) و با چگالی این کسری ها مطابقت دارد. لیپیدهای غذایی به داخل chylomicrons جمع می شوند ، اکثر تری گلیسرول های موجود در آنها توسط لیپوپروتئین لیپاز به داخل چربی و بافت ماهیچه ای در مویرگ ها آزاد می شوند. باقیمانده های کلیومایکرون (حاوی عمدتا پروتئین و کلسترول) توسط سلولهای کبدی اسیر می شوند. لیپیدهای درون زا و کلسترول از کبد به شکل VLDL به بافت چربی و عضله تحویل داده می شوند. ترشح لیپیدها از VLDL (همراه با از بین رفتن برخی از آپولیپوپروتئین ها) به تدریج VLDLP را به LDL تبدیل می کند ، که کلسترول را به بافت های خارج کبدی منتقل می کند یا آن را به کبد باز می گرداند. کبد بقایای VLDL ، LDL و بقایای کیلو میکرون ها را با آندوسیتوز گیرنده دریافت می کند. کلسترول بیش از حد در بافتهای خارج کبدی به شکل LDL به کبد منتقل می شود. در کبد ، بخشی از کلسترول به نمک صفرا تبدیل می شود. ب - نمونه های پلاسمائی خون گرفته شده بعد از گرسنگی (سمت چپ) و بعد از خوردن غذا با چربی زیاد (راست). Chylomicrons که با خوردن غذاهای چرب ایجاد می شود ، به پلاسما شباهت بیرونی به شیر می دهد.

با از بین رفتن تریسیلیل گلیسرول ها ، بخشی از VLDL به باقیمانده های VLDL تبدیل می شود ، که به آن لیپوپروتئین های با چگالی میانی نیز گفته می شود (VLDL) ، حذف بیشتر تری اسیل گلیسرول ها از VLDL می دهد. لیپوپروتئین های با چگالی کم (LDL) (برگه 21-1). کسر LDL ، که سرشار از کلسترول و کلسترول استر است و همچنین حاوی apoB-100 است ، کلسترول را به بافتهای خارج کبدی منتقل می کند که گیرنده های خاصی را دارند که می شناسند apoB-100 را بر روی غشاهای پلاسمایی خود تشخیص می دهد. این گیرنده ها واسطه جذب کلسترول و استرهای کلسترول هستند (مطابق شکل زیر).
ضمیمه 21-2.آللهای ApoE شیوع بیماری آلزایمر را تعیین می کنند
در جمعیت انسانی ، سه نوع شناخته شده (سه آلل) ژن رمزگذاری شده آپولیپوپروتئین E. از آللهای apoE در انسان ، آلل APOEZ رایج ترین (حدود 78٪) ، آللهای APOE4 و APOE2 به ترتیب 15 و 7٪ است. آلل APOE4 خصوصاً برای افراد مبتلا به آلزایمر مشخص است و این رابطه امکان پیش بینی وقوع این بیماری را با احتمال زیاد فراهم می آورد. افرادی که APOE4 را به ارث برده اند در معرض خطر ابتلا به بیماری اواخر آلزایمر هستند. افرادی که هموزن APOE4 دارند 16 برابر بیشتر در معرض ابتلا به این بیماری هستند ، میانگین سنی افرادی که مریض می شوند حدود 70 سال سن دارند. در مقابل ، برای افرادی که دو نسخه از AROEZ را به ارث می برند ، برعکس ، میانگین سنی بیماری آلزایمر از 90 سال بیشتر است.
مبنای مولکولی برای ارتباط بین apoE4 و بیماری آلزایمر هنوز ناشناخته است. علاوه بر این ، هنوز مشخص نیست که چگونه apoE4 می تواند بر رشد تارهای آمیلوئید ، که ظاهراً علت اصلی بیماری آلزایمر است ، تأثیر بگذارد (نگاه کنید به شکل 4-31 ، v. 1). فرضیات بر نقش احتمالی apoEE در تثبیت ساختار اسکلت اسکلتی نورونها تمرکز دارند. پروتئین های apoE2 و apoEZ به تعدادی از پروتئین های مرتبط با میکروتوبول های نورون ها متصل می شوند ، در حالی که apoE4 به هم متصل نمی شود. این می تواند مرگ نورون ها را تسریع کند. هرچه ممکن است این مکانیسم به نظر برسد ، این مشاهدات امید به گسترش درک ما از عملکردهای بیولوژیکی آپولیپوپروتئینها را می دهد.
نوع چهارم لیپوپروتئین ها - لیپوپروتئینهای با چگالی بالا (HDL) ، این بخش در کبد و روده کوچک به شکل ذرات غنی از پروتئین حاوی کلسترول نسبتاً کمی و کاملاً عاری از استرهای کلسترول تشکیل می شود (شکل 21-40). بخش HDL حاوی apoA-I ، apoC-I ، apoC-II و سایر آپولیپوپروتئین ها (جدول 21-2) و همچنین لسیتین-کلسترول- آسییل ترانسفراز (LC AT) ، که باعث تشکیل کاتالیز استرهای کلسترول از لسیتین (فسفاتیدیل کلولین) و کلسترول می شود (شکل 21-41). L CAT بر روی سطح ذرات HDL تازه تشکیل شده ، کلسترول chylomicron و فسفاتیدیل کولین و VLDL را به استرهای کلسترول تبدیل می کند ، که شروع به تشکیل هسته می کنند و ذرات HDL تازه تشکیل یافته HDL را به ذرات بالغ کروی HDL تبدیل می کنند. این لیپوپروتئین سرشار از کلسترول سپس به کبد برمی گردد ، جایی که "کلسترول" تخلیه می شود ، مقداری از این کلسترول به نمک های صفراوی تبدیل می شود.
شکل 21-41 واکنش کاتالیز شده توسط لسیتین کلسترول- آسیل ترانسفراز (L CAT). این آنزیم در سطح ذرات HDL موجود است و توسط apoA-1 (مؤلفه ای از کسر HDL) فعال می شود. استرهای کلسترول در ذرات HDL تازه تشکیل شده جمع می شوند و آنها را به HDL بالغ تبدیل می کنند.

HDL توسط اندوسیتوز ناشی از گیرنده می تواند در کبد جذب شود ، اما حداقل برخی از کلسترول HDL توسط مکانیسم های دیگر به بافت های دیگر تحویل داده می شود. ذرات HDL می توانند به پروتئین های گیرنده SR - BI در غشای پلاسمایی سلولهای کبدی و در بافت استروئیدوژن مانند غدد فوق کلیوی متصل شوند. این گیرنده ها واسطه اندوسیتوز نیستند ، بلکه انتقال جزئی و انتخابی کلسترول و سایر لیپیدهای بخش HDL به سلول است. کسری HDL "کاهش یافته" دوباره وارد جریان خون می شود ، جایی که بخش های جدیدی از لیپیدهای موجود در کیلو میکرون ها و باقیمانده های VLDL را شامل می شود. همان HDL همچنین می تواند کلسترول ذخیره شده در بافت های خارج کبدی را ضبط کرده و توسط آن به کبد منتقل شود انتقال کلسترول معکوس (شکل 21-40). در یکی از انواع حمل و نقل معکوس ، اثر متقابل HDL حاصل با گیرنده های SR-BI در سلول های غنی از کلسترول ، انتشار منفعل کلسترول از سطح سلول را به ذرات HDL آغاز می کند ، که سپس کلسترول را به کبد منتقل می کنند. در نوع دیگری از حمل و نقل معکوس در یک سلول کلسترول غنی ، پس از قطع HDL ، apoA-I با انتقال دهنده فعال ، پروتئین ABC در تعامل است. ApoA-I (و احتمالاً HDL) توسط اندوسیتوز جذب می شود و دوباره ترشح می شود ، پر از کلسترول می شود ، که به کبد منتقل می شود.
پروتئین ABC1 بخشی از خانواده زیادی از حاملان بسیاری از داروها است ، این حامل ها بعضاً انتقال دهنده های ABC نامیده می شوند ، زیرا همه آنها دارای کاست های اتصال دهنده ATP هستند (ATP - کاست های اتصال دهنده) ، آنها همچنین دارای دو حوزه ترانسمیبرونی با شش مارپیچ transmembrane هستند (به بخش مراجعه کنید). 11 ، در مقابل 1). این پروتئین ها به طور فعال بسیاری از یون ها ، اسیدهای آمینه ، ویتامین ها ، هورمون های استروئیدی و نمک های صفراوی را از طریق غشاهای پلاسما منتقل می کنند. نماینده دیگر این خانواده از حامل ها پروتئین CFTR است که با فیبروز کیستیک آسیب دیده است (به شماره 11-3 ، v.1 مراجعه کنید).
استرهای کلسترول از طریق اندوسیتوز با واسطه گیرنده وارد سلول می شوند
هر ذره LDL در جریان خون حاوی apoB-100 است که توسط پروتئین های گیرنده سطح خاصی شناخته می شود -گیرنده های LDL بر روی غشای سلولهایی که نیاز به جذب کلسترول دارند. اتصال LDL به گیرنده LDL باعث آندوسیتوز می شود ، به همین دلیل LDL و گیرنده آن به درون سلول درون اندوزوم منتقل می شوند (شکل 21-42). در نهایت اندوزوم با لیزوزوم ترکیب می شود ، که حاوی آنزیم هایی است که هیدرولیز استرهای کلسترول را هیدرولیز می کند و کلسترول و اسیدهای چرب را به داخل سیتوزول آزاد می کند. ApoB-100 از LDL همچنین تجزیه می شود تا اسیدهای آمینه را که در داخل سیتوزول ترشح می شوند تشکیل شود ، اما گیرنده LDL از تخریب جلوگیری می کند و به سطح سلول باز می گردد تا دوباره در جذب LDL شرکت کند. ApoB-100 در VLDL نیز حضور دارد ، اما حوزه اتصال گیرنده آن قادر به اتصال به گیرنده LDL نیست ؛ تبدیل VLDLP به LDL دامنه اتصال گیرنده را به apoB-100 در دسترس می کند. این مسیر انتقال کلسترول خون و اندوسیتوز ناشی از گیرنده آن در بافتهای هدف توسط مایکل براون و جوزف گلدشتاین مورد مطالعه قرار گرفته است.
مایکل براون و جوزف گلدشتاین

شکل 21-42. ضبط کلسترول توسط آندوسیتوز با واسطه گیرنده.

کلسترول ، که از این طریق وارد سلول ها می شود ، می تواند در غشاها وارد شود یا توسط ACAT (شکل 21-38) مجدداً استریت شود تا در سیتوزول درون قطرات لیپیدی ذخیره شود. وقتی کلسترول کافی در بخش LDL خون موجود باشد ، از کاهش تجمع کلسترول داخل سلولی با کاهش میزان سنتز آن جلوگیری می شود.
گیرنده LDL همچنین به apoE متصل می شود و نقش مهمی در جذب کلیومایکرون ها و باقی مانده های VLDL توسط کبد دارد. با این حال ، اگر گیرنده های LDL در دسترس نباشد (به عنوان مثال ، در یک فشار ماوس با ژن گیرنده LDL گمشده) ، باقیمانده های VLDL و کایلومیکرون ها هنوز توسط کبد جذب نمی شوند ، اگرچه LDL جذب نمی شود. این نشان دهنده وجود یک سیستم ذخیره کمکی برای اندوسیتوز گیرنده با واسطه مانده های VLDL و کلیومایکرون است. یکی از گیرنده های ذخیره پروتئین LRP (پروتئین مربوط به گیرنده لیپوپروتئین) است ، که مربوط به گیرنده های لیپوپروتئین است ، که به apoE و تعدادی از لیگاند های دیگر متصل می شود.
چندین سطح تنظیم بیوسنتز کلسترول
سنتز کلسترول یک فرایند پیچیده و پرانرژی است ، بنابراین مشخص است که بدن برای داشتن مکانیسم تنظیم بیوسنتز کلسترول مفید است ، که علاوه بر آنچه با غذا همراه است ، مقدار آن را دوباره پر می کند. در پستانداران ، تولید کلسترول با غلظت داخل سلولی تنظیم می شود
کلسترول و هورمون ها گلوکاگون و انسولین. مرحله تبدیل HMG - CoA به mvalonate (شکل 21-34) سرعت در مسیر متابولیک تشکیل کلسترول (نکته اصلی تنظیم) را محدود می کند. این واکنش توسط ردوکتاز HMG - CoA کاتالیز می شود. تنظیم در پاسخ به تغییر در سطح کلسترول توسط یک سیستم تنظیم رونویسی زیبا برای یک ژن رمزگذار HMG - CoA ردوکتاز واسطه می شود. این ژن به همراه بیش از 20 ژن دیگر آنزیم رمزکننده که در جذب و سنتز کلسترول و اسیدهای چرب اشباع نشده دخیل هستند ، توسط خانواده کوچکی از پروتئین ها به نام پروتئین ها کنترل می شوند که با عنصر تنظیم کننده استرول در تشکیل پروتئین در تعامل هستند (SREBP ، عنصر تنظیم کننده استرول اتصال پروتئین ها). . پس از سنتز ، این پروتئین ها در شبکه آندوپلاسمی وارد می شوند. تنها دامنه SREBP آمینو ترمینال محلول به عنوان یک فعال کننده رونویسی با استفاده از مکانیسم های توصیف شده در Ch فعالیت می کند. 28 (برابر 3). با این حال ، این دامنه به هسته دسترسی ندارد و تا زمانی که در مولکول SREBP باقی بماند ، نمی تواند در فعال سازی ژن شرکت کند. به منظور فعال سازی رونویسی ژن HMG - CoA ردوکتاز و سایر ژنها ، دامنه فعال رونویسی با استفاده از پروتئولیتیک از بقیه SREBP جدا می شود. هنگامی که کلسترول بالا است ، پروتئین های SREBP غیرفعال هستند ، در یک پروتئین با نام پروتئین دیگر به نام SCAP (پروتئین فعال کننده شکاف SREBP - SREBP) بر روی ER تنظیم می شوند (شکل 21-43). این SCAP است که کلسترول و تعدادی استرول دیگر را به هم متصل می کند و به عنوان یک سنسور استرول عمل می کند. هنگامی که سطح استرول بالا باشد ، مجموعه SCAP - SREBP احتمالاً با پروتئین دیگری ارتباط برقرار می کند ، که کل این مجتمع را در ER حفظ می کند. هنگامی که سطح استرول ها در سلول کاهش می یابد ، تغییر ساختار در SCAP منجر به از بین رفتن فعالیت احتباس می شود و مجموعه SCAP - SREBP در داخل وزیکول ها به مجتمع Golgi مهاجرت می کند. در مجتمع Golgi ، پروتئین های SREBP دو بار توسط دو پروتئاز مختلف بریده می شوند ، شکاف دوم که دامنه آمینو ترمینال را درون سیتوزول آزاد می کند. این دامنه به سمت هسته حرکت می کند و رونویسی از ژن های هدف را فعال می کند. دامنه پروتئین SREBP آمینو ترمینال نیمه عمر کوتاهی دارد و به سرعت توسط پروتئازومها تجزیه می شود (شکل 27-48 ، تی 3 را ببینید). هنگامی که سطح استرول به اندازه کافی بالا می رود ، انتشار پروتئولیتیک حوزه پروتئین SR EBP با پایانه آمینه دوباره مسدود می شود ، و تخریب پروتئازوم حوزه های فعال موجود منجر به خاموش شدن سریع ژن های هدف می شود.
شکل 21-43 فعال سازی SR EBP. پروتئین های SREB P در تعامل با یک عنصر تنظیم شده با استرول (رنگ سبز) ، بلافاصله پس از سنتز ، وارد ER می شوند و یک مجموعه با S CAP (رنگ قرمز) تشکیل می دهند. (N و C انتهای آمین و کربوکسیل پروتئین ها را مشخص می کند.) در حالت محدود شده S-CAP پروتئین های SRE BP غیرفعال هستند. هنگامی که سطح استرول کاهش می یابد ، مجموعه SR EBP-S CAP به مجموعه Golgi مهاجرت می کند ، و پروتئین های SR EBP به طور متوالی توسط دو پروتئاز مختلف بریده می شوند. دامنه پروتئین ترمینال اسید آمینه SR EBP آزاد شده به هسته ، که در آن رونویسی ژنهای تنظیم شده با استرول را فعال می کند ، مهاجرت می کند.

سنتز کلسترول همچنین توسط چندین مکانیسم دیگر تنظیم شده است (شکل 21-44). کنترل هورمونی با اصلاح کووالانسی ردوکتاز NMG-CoA واسطه می شود. این آنزیم در اشکال فسفریله (غیرفعال) و دفسفریله (فعال) وجود دارد. گلوکاگون فسفوریلاسیون (غیرفعال سازی) آنزیم را تحریک می کند ، و انسولین باعث تقویت دفسفوریلاسیون ، فعال کردن آنزیم و به نفع سنتز کلسترول می شود. غلظت داخل سلولی کلسترول بالا ASAT را فعال می کند ، که باعث افزایش اسید کلسترول برای رسوب می شود. سرانجام ، مقادیر بالای کلسترول سلولی مانع از رونویسی از ژن هایی که یک گیرنده LDL را رمزگذاری می کنند ، باعث کاهش تولید این گیرنده و بنابراین جذب کلسترول از خون می شود.
شکل 21-44 تنظیم سطح کلسترول تعادل بین سنتز و جذب کلسترول از مواد غذایی را فراهم می کند. گلوکاگون باعث تسهیل فسفوریلاسیون (غیرفعال شدن) NMR-ردوکتاز NMG-CoA می شود ، انسولین باعث تقویت دیفسفوریلاسیون (فعال سازی) می شود. X - متابولیتهای کلسترول ناشناس که تحریک پروتئولیز NMG -CoA ردوکتاز است.

کلسترول کنترل نشده می تواند منجر به بیماری جدی در انسان شود. هنگامی که کل کلسترول سنتز شده و کلسترول بدست آمده از غذا بیش از مقدار مورد نیاز برای مونتاژ غشای ، سنتز نمکهای صفراوی و استروئیدها باشد ، ممکن است تجمعهای پاتولوژیک کلسترول در رگهای خونی (پلاکهای آترواسکلروتیک) ظاهر شود و منجر به انسداد آنها (آترواسکلروز) شود. در کشورهای صنعتی به دلیل انسداد عروق کرونر که علت اصلی مرگ و میر است ، نارسایی قلبی است. توسعه آترواسکلروز با سطح بالای کلسترول خون و به ویژه با سطح بالای کلسترول منتقل شده با کسری LDL همراه است و سطح بالای خون HDL برعکس ، بر وضعیت عروق خونی اثر مطلوبی دارد.
با وجود کلسترول خون ارثی (یک نقص ژنتیکی) ، سطح کلسترول خون بسیار بالا است - آترواسکلروز شدید در این افراد در دوران کودکی بروز می کند. به دلیل گیرنده LDL معیوب ، جذب کافی واسطه گیرنده از کلسترول LDL رخ می دهد. در نتیجه ، کلسترول از جریان خون خارج نمی شود ، بلکه در تشکیل پلاک های آترواسکلروتیک جمع می شود و به آن کمک می کند. سنتز کلسترول درون زا با وجود کلسترول اضافی موجود در خون ، همچنان ادامه دارد ، زیرا کلسترول خارج سلولی نمی تواند برای تنظیم سنتز داخل سلولی وارد سلول شود (شکل 21-44).برای درمان بیماران مبتلا به هیپر کلسترول ارثی و سایر بیماریهای مرتبط با افزایش کلسترول سرم ، از کلاس های استاتین استفاده می شود. برخی از آنها از منابع طبیعی به دست می آیند ، برخی دیگر توسط صنایع داروسازی ساخته می شوند. استاتین ها مشابه موالونات هستند (اضافه کنید 21-3) و مهار کننده های رقابتی NMS-CoA ردوکتاز هستند.
ضمیمه 21-3. دارو فرضیه لیپید و ایجاد استاتین
بیماری عروق کرونر قلب (CHD) عامل اصلی مرگ و میر در کشورهای توسعه یافته است. باریک شدن عروق کرونر که خون را به قلب منتقل می کند در نتیجه تشکیل رسوبات چربی به نام پلاک های آترواسکلروتیک اتفاق می افتد ؛ این پلاک ها حاوی کلسترول ، پروتئین های فیبریلار ، کلسیم ، لخته های پلاکت و قطعات سلول هستند. در قرن XX. بحث فعال در مورد رابطه بین انسداد شریانی (آترواسکلروز) و کلسترول خون بود. این بحث ها و تحقیقات فعال در این راستا منجر به ایجاد داروهای مؤثر برای کاهش کلسترول شده است.
در سال 1913 ، ن.ن. آنیچکوف ، دانشمند مشهور روسی و متخصص آسیب شناسی تجربی ، اثری را منتشر کرد که در آن اثبات کرد که خرگوشهایی که با غذای غنی از کلسترول تغذیه می شوند ، به رگ های خونی آسیب می رسانند که شبیه پلاک های آترواسکلروتیک در عروق افراد سالخورده است. آنیچکوف تحقیقات خود را برای چندین دهه انجام داده و نتایج را در مجلات شناخته شده غربی منتشر کرده است. متأسفانه ، داده های او مبنایی برای الگویی برای ایجاد آترواسکلروز در انسان قرار نگرفت ، زیرا در آن زمان این فرضیه حاکم بود که این بیماری نتیجه طبیعی پیری است و نمی توان از آن جلوگیری کرد. با این حال ، شواهد به تدریج در حال جمع شدن رابطه بین کلسترول سرم و ایجاد آترواسکلروز (فرضیه لیپید) و در دهه 1960 بود. برخی محققان صریحاً اظهار داشتند كه این بیماری با داروها قابل درمان است. با این وجود ، نقطه نظر مخالف تا زمان انتشار نتایج در سال 1984 ، نتایج یک مطالعه گسترده در مورد نقش کلسترول توسط انستیتوی ملی بهداشت ایالات متحده (آزمایش پیشگیری اولیه عروق کرونر) وجود داشته است. از نظر آماری کاهش معنی داری در فراوانی انفارکتوس میوکارد و سکته های مغزی با کاهش کلسترول خون نشان داده شد. در این مطالعه از کلسترول ، یک رزین تبادل آنیون که اسیدهای صفراوی را به هم متصل می کند ، برای کاهش کلسترول استفاده شد. این نتایج ، جستجوی داروهای درمانی جدید و قدرتمندتر را تحریک کرده است. باید بگویم که در دنیای علمی ، تردیدها در مورد اعتبار فرضیه لیپیدها فقط با ظهور استاتین در اواخر دهه 1980 - اوایل دهه 1990 ناپدید شد.
اولین استاتین توسط آکیرا اندو در سانکیو در توکیو کشف شد. Endo کار خود را در سال 1976 منتشر کرد ، اگرچه برای چندین سال با مشکل متابولیسم کلسترول سر و کار داشت. در سال 1971 ، وی اظهار داشت كه مهار كننده های سنتز كلسترول نیز در تولیدكنندگان قارچ آنتی بیوتیك هایی كه در آن زمان مورد مطالعه قرار می گرفت نیز می تواند موجود باشد. وی برای چندین سال کار فشرده ، بیش از 6000 فرهنگ قارچ های مختلف را تحلیل کرد ، تا اینکه به نتیجه مثبتی رسید. ترکیب حاصل کامپکتین نامیده شد. این ماده باعث کاهش کلسترول در سگ ها و میمون ها شد. این مطالعات توجه مایکل براون و جوزف گلدشتاین از دانشکده پزشکی دانشگاه تگزاس جنوب غربی را به خود جلب کرد. براون و گلدشتاین به همراه اندو یک مطالعه مشترک را آغاز کردند و داده های وی را تأیید کردند. موفقیتهای اصلی اولین کارآزمایی های بالینی شرکتهای داروسازی را در تولید این داروهای جدید درگیر کرده است. در مركس ، تيمي به سرپرستي آلفرد آلبرتز و روي واژلوس غربالگري جديدي از كشت هاي قارچ را راه اندازي كردند و در نتيجه تجزيه و تحليل درمجموع 18 كشت ، داروي فعال ديگري كشف كردند. ماده جدید لواستاتین نام دارد. با این حال ، در همان زمان ، اعتقاد بر این بود که مصرف دوزهای زیاد کامپکتین به سگ منجر به پیشرفت سرطان و جستجوی استاتین های جدید در دهه 1980 می شود. به حالت تعلیق درآمده است با این حال ، در آن زمان ، مزایای استفاده از استاتین برای معالجه بیماران مبتلا به فشار خون بالا خانوادگی از قبل آشکار بود. پس از مشاوره های متعدد با کارشناسان بین المللی و سازمان غذا و داروی (FDA ، ایالات متحده) ، مرك شروع به تولید لوواستاتین كرد. مطالعات گسترده طی دو دهه آینده ، اثر سرطان زایی لوواستاتین و نسل جدیدی از داروهایی که پس از آن ظاهر می شوند را آشکار نکرده است.
شکل 1. استاتین ها مهار کننده ردوکتاز NM G-CoA هستند. مقایسه ساختار موالونات و چهار فرآورده دارویی (استاتین) که باعث مهار عمل ردوکتاز NMG-CoA می شوند.

استاتین ها مهار عمل HMG - CoA - ردوکتاز ، تقلید از ساختار میوونونات ، و در نتیجه سنتز کلسترول را مسدود می کند. در بیماران مبتلا به هایپر کلسترول خون ناشی از نقص در یک نسخه از ژن گیرنده LDL ، هنگام مصرف لوواستاتین ، میزان کلسترول 30٪ کاهش می یابد. این دارو حتی در ترکیب با رزین های ویژه ای که اسیدهای صفراوی را به هم متصل می کنند ، موثرتر است و از جذب معکوس آنها از روده جلوگیری می کند.
در حال حاضر ، استاتین ها اغلب برای کاهش کلسترول پلاسما خون استفاده می شوند. هنگام مصرف هرگونه دارو ، این سؤال در مورد عوارض جانبی نامطلوب آنها ایجاد می شود. با این حال ، در مورد استاتین ها ، برعکس ، بسیاری از عوارض جانبی مثبت هستند. این داروها می توانند جریان خون را تحریک کرده ، پلاک های آترواسکلروتیک موجود را برطرف کنند (به طوری که از دیواره رگ های خونی جدا نشوند و جریان خون را درگیر نکنند) ، تجمع پلاکت ها را مهار کرده و همچنین باعث تضعیف فرآیندهای التهابی در دیواره رگ های خونی می شوند. در بیمارانی که برای اولین بار استاتین مصرف می کنند ، این اثرات حتی قبل از شروع کاهش سطح کلسترول آشکار می شود و احتمالاً با مهار سنتز ایزوپرونوئید همراه است. البته ، هر اثر جانبی استاتین ها مفید نیستند. در بعضی از بیماران (معمولاً در بین بیمارانی که استاتین ها را بهمراه سایر داروهای کاهش دهنده کلسترول مصرف می کنند) ، درد عضلانی و ضعف عضلات ایجاد می شود و گاهی اوقات به شکلی نسبتاً قوی. سایر عوارض جانبی بسیار زیاد استاتین ها نیز ثبت شده است که خوشبختانه بندرت رخ می دهد. در اکثریت قریب به اتفاق بیماران ، مصرف استاتین می تواند پیشرفت بیماری قلبی عروقی را مهار کند. مانند هر داروی دیگری ، استاتین ها فقط باید طبق توصیه پزشک استفاده شوند.

با فقدان ارثی کلسترول HDL ، سطح کلسترول بسیار پایین است ، با بیماری Tangier ، کلسترول عملا مشخص نمی شود. هر دو اختلال ژنتیکی ناشی از جهش در پروتئین ABC1 هستند. کسری از کلسترول بدون HDL نمی تواند کلسترول را از سلولهای کمبود ABC1 جذب کند ، و سلولهای ضعیف کلسترول به سرعت از خون خارج می شوند و از بین می روند. فقدان ارثی بیماری HDL و بیماری Tangier بسیار نادر است (کمتر از 100 خانواده مبتلا به بیماری Tangier در سراسر جهان شناخته شده اند) ، اما این بیماری ها نقش پروتئین ABC1 را در تنظیم سطح پلاسمایی HDL نشان می دهد. از آنجا که سطح HDL پلاسما پایین با میزان بالای آسیب عروق کرونر ارتباط دارد ، پروتئین ABC1 ممکن است یک هدف مفید برای داروهایی باشد که برای تنظیم سطح HDL طراحی شده اند. ■
هورمونهای استروئیدی با تقسیم زنجیره جانبی کلسترول و اکسیداسیون آن تشکیل می شوند.
فرد تمام هورمونهای استروئیدی خود را از کلسترول دریافت می کند (شکل 21-45). دو کلاس هورمونهای استروئیدی در قشر آدرنال سنتز می شوند: قشرهای معدنی ،تنظیم کننده جذب یونهای معدنی (Na + ، Cl - و HC O) است 3 -) در کلیه ها ، و گلوکوکورتیکوئیدها ، که به تنظیم گلوکونوژنز و کاهش پاسخ التهابی کمک می کند. هورمونهای جنسی در سلولهای تولید مثل زن و مرد و جفت تولید می شوند. در میان آنها پروژسترون که چرخه تولید مثل زنان را تنظیم می کند ، آندروژن ها (مثلاً تستوسترون) و استروژن ها (استرادیول) که به ترتیب بر رشد خصوصیات جنسی ثانویه در زنان و مردان تأثیر می گذارد. هورمونهای استروئیدی در غلظت های بسیار کم تأثیر دارند و بنابراین در مقادیر نسبتاً کمی سنتز می شوند. در مقایسه با نمکهای صفراوی ، کلسترول نسبتاً کمی برای تولید هورمونهای استروئیدی مصرف می شود.

شکل 21-45 برخی از هورمونهای استروئیدی از کلسترول تشکیل شده اند. ساختار برخی از این ترکیبات در شکل نشان داده شده است. 10-19 ، مقابل 1.

سنتز هورمونهای استروئیدی نیاز به از بین بردن چندین یا تمام اتم های کربن در "زنجیره جانبی" حلقه D-17 کلسترول دارد. برداشتن زنجیره جانبی در میتوکندری بافتهای استروئیدی رخ می دهد. فرآیند حذف از هیدروکسیلاسیون دو اتم کربن مجاور زنجیره جانبی (C-20 و C-22) و سپس شکاف پیوند بین آنها تشکیل شده است (شکل 21-46). تشکیل هورمونهای مختلف همچنین شامل معرفی اتمهای اکسیژن است. تمام واکنشهای هیدروکسیلاسیون و اکسیداسیون در طول بیوسنتز استروئید توسط اکسیدازهای با عملکرد مختلط (اضافه کردن 21-1) که از NA D PH ، O استفاده می کنند ، کاتالیز می شود. 2 و سیتوکروم میتوکندری P-450.
شکل 21-46 شکاف زنجیره جانبی در سنتز هورمونهای استروئیدی. در این سیستم اکسیداز با عملکردی مخلوط که اتمهای مجاور کربن را اکسید می کند ، سیتوکروم P-450 به عنوان حامل الکترون عمل می کند. پروتئین های انتقال دهنده الکترونی ، آدرنودوکسین و آدرنودوکسین ردوکتاز نیز در این فرآیند نقش دارند. این سیستم تقسیم زنجیره جانبی در میتوکندری قشر آدرنال ، جایی که تولید فعال استروئیدها انجام می شود ، یافت شد. Pregnenolone پیشرو سایر هورمونهای استروئیدی است (شکل 21-45).

واسطه های بیوسنتز کلسترول در بسیاری از مسیرهای متابولیک دیگر نقش دارند.
علاوه بر نقش خود به عنوان واسطه بیوسنتز کلسترول ، ایزوپنتنیل پیروفسفات به عنوان یک پیشرو فعال در سنتز تعداد زیادی از مولکولهای زیستی که عملکردهای مختلف بیولوژیکی را انجام می دهند (شکل 21-47). اینها شامل ویتامین های A ، E و K ، رنگدانه های گیاهی مانند کاروتن و کلروفیل فیتول زنجیره ای ، لاستیک طبیعی ، بسیاری از روغنهای اساسی (به عنوان مثال پایه معطر روغن لیمو ، اکالیپتوس ، مشک) ، هورمون جوانی در حشرات است که دگرگونی ، دلیچول ها را تنظیم می کند. به عنوان حامل محلول در لیپیدها در سنتز پیچیده پلی ساکاریدها ، یوبیوکینون و پلاستوکینون - حاملهای الکترونی در میتوکندریها و کلروپلاستها خدمت می کنند. تمام این مولکولها از لحاظ ساختاری ایزوپرونوئیدها هستند. بیش از 20،000 ایزوپرونوئید مختلف در طبیعت یافت شده است ، و صدها مورد جدید هر ساله گزارش می شود.
شکل 21-47. تصویر کلی بیوسنتز ایزوپرونوئیدها. ساختار اکثر محصولات نهایی ارائه شده در اینجا در بخش آورده شده است. 10 (برابر 1).

پردنیلاسیون (پیوستگی کووالانسی ایزوپرونوئید ، شکل 27-35 را ببینید) مکانیسم مشترکی است که توسط آن پروتئین ها روی سطح داخلی غشاهای سلولی پستانداران لنگر می روند (شکل 11-14). در برخی پروتئین ها ، چربی محدود توسط یک گروه 15 عیار کربن فارنسیل نمایان می شود ، در برخی دیگر این گروه 20٪ کربن گرانیل گرانیل است. این دو نوع لیپید آنزیمهای مختلفی را به هم متصل می کنند. این امکان وجود دارد که واکنش های prenylation بسته به چسبندگی چربی به پروتئین ها به غشاهای مختلف هدایت شود. شرکت کنندگان در مسیر متابولیک کلسترول نقش مهمی پروتئین نقش مهم دیگری در مشتقات ایزوپرن دارند.
خلاصه بخش 21.4 بیوسنتز کلسترول ، استروئیدها و ایزوپرونوئیدها
■ کلسترول از استیل-CoA در یک دنباله واکنش پیچیده از طریق واسطه هایی مانند β-هیدروکسی-β-متیلگلوتاریل-CoA ، میوالونات ، دو ایزوپرن دی متیلالیل پیروفسفات و ایزوپنتنیل پیروفسفات تشکیل می شود. تراکم واحدهای ایزوپرن به اسکالن غیر چرخه ای می دهد ، که برای تشکیل یک سیستم حلقه چگال شده و زنجیره جانبی استروئید ، چرخه ای می کند.
■ سنتز کلسترول تحت کنترل هورمونی است و علاوه بر این ، با افزایش غلظت کلسترول داخل سلولی ، که از طریق اصلاح کووالانسی و تنظیم رونویسی رخ می دهد ، مهار می شود.
■ استرهای کلسترول و کلسترول به عنوان لیپوپروتئین های پلاسما توسط خون حمل می شوند. کسر VLDL کلسترول ، استرهای کلسترول و تری اسیل گلیسرولها را از کبد به بافتهای دیگر منتقل می کند ، جایی که تری گلیسرول ها توسط لیپوپروتئین لیپاز بریده می شوند و VLDL به LDL تبدیل می شود. کسری LDL غنی شده در استرهای کلسترول و کلسترول به طور غیر مستقیم توسط گیرنده ها توسط اندوسیتوز اسیر می شود ، در حالی که آپولیپوپروتئین B-100 در LDL توسط گیرنده های غشای پلاسما شناخته می شود. HDL کلسترول را از خون خارج کرده و آن را به کبد منتقل می کند. شرایط تغذیه ای یا نقص ژنتیکی در متابولیسم کلسترول می تواند منجر به تصلب شرایین و انفارکتوس میوکارد شود.
horm هورمون های استروئیدی (گلوکوکورتیکوئیدها ، مواد معدنی کورتیکوئیدها و هورمون های جنسی) از طریق کلسترول با تغییر زنجیره جانبی و وارد کردن اتم های اکسیژن در سیستم استروئیدی حلقه ها تشکیل می شوند. بسیاری دیگر از ترکیبات ایزوپرونوئید از میوونونات با تراکم ایزوپنتنیل پیروفسفات و پیروفسفات دی متیلالیل به همراه کلسترول تولید می شوند.
ren پروتئین شدن پروتئین های خاص آنها را به سمت محل های اتصال با غشای سلولی هدایت می کند و برای فعالیت بیولوژیکی آنها مهم است.
سؤال 48. تنظیم متابولیسم اسیدهای چرب زیاد (β- اکسیداسیون و بیوسنتز). سنتز مالونیل CoA. استیل CoA کربوکسیلاز ، تنظیم فعالیت آن. انتقال acyl Co-a از طریق غشای داخلی میتوکندری.
اصلی
مقدار فنیل آلانین مصرف می شود
به 2 روش:
روشن می شود
در سنجاب ها ،
نوبت
در تیروزین
در حال چرخاندن
فنیل آلانین به تیروزین در درجه اول
برای از بین بردن اضافی لازم است
فنیل آلانین ، از آنجا که غلظت بالایی دارد
برای سلولها سمی است. آموزش
تیروزین مهم نیست
از فقدان این اسید آمینه
در سلولها عملاً اتفاق نمی افتد.
اصلی
متابولیسم فنیل آلانین شروع می شود
با هیدروکسیلاسیون آن (شکل 9-29) ، در
و در نتیجه تیروزین.
این واکنش توسط یک خاص کاتالیز می شود
monooxy-nase - فنیل آلانین هیدرا (زسیلاز ،
که به عنوان یک سرو است
تتراهیدروبیوپتین (N4BP).
فعالیت آنزیم نیز بستگی دارد
حضور Fe2.
در
کبد در ابتدا بسیج شتاب است
گلیکوژن (به بخش 7 مراجعه کنید). با این حال سهام
گلیکوژن در کبد از بین می رود
ساعت 18-24 روزه. منبع اصلی
گلوکز به عنوان سهام از بین می رود
گلیکوژن تبدیل به گلوکونوژنز می شود ،
که شروع به شتاب از طریق
شکل
11-29. تغییرات عمده متابولیک
انرژی هنگام تغییر جاذب
حالت پسابرابر سی تی اسکن
- بدن کتون ، اسیدهای چرب FA.
4-6 ساعت
بعد از آخرین غذا بسترها
گلیسرول برای سنتز گلوکز استفاده می شود ،
اسیدهای آمینه و لاکتات. بالا
میزان سنتز غلظت گلوکاگون
اسیدهای چرب به دلیل کاهش می یابد
فسفوریلاسیون و غیرفعال کردن
استیل CoA کربوکسیلاز و میزان
اکسیداسیون p افزایش می یابد. با این حال ،
افزایش چربی به کبد
اسیدهای منتقل شده
از انبارهای چربی استیل-CoA تشکیل شد
در اکسیداسیون اسیدهای چرب از آن استفاده می شود
در کبد برای سنتز بدن کتون.
در
بافت چربی با افزایش غلظت
گلوکاگون میزان سنتز را کاهش داد
TAG و لیپولیز تحریک می شود. تحریک
لیپولیز - نتیجه فعال سازی
حساس به هورمون TAG لیپاز
سلولهای چربی تحت تأثیر گلوکاگون.
اسیدهای چرب اهمیت زیادی پیدا می کنند
منابع انرژی در کبد ، ماهیچه ها و
بافت چربی.
بنابراین
بنابراین ، در دوره پس از جذب
غلظت گلوکز خون حفظ می شود
در سطح 80-100 میلی گرم در دسی لیتر و سطح چربی
اسیدها و بدنهای کتون افزایش می یابد.
شکر
دیابت نوعی بیماری است که بروز می کند
به دلیل مطلق یا نسبی
کمبود انسولین
الف
اشکال اصلی بالینی قند
دیابت
طبق
سازمان جهانی
دیابت مراقبت های بهداشتی
طبق اختلاف طبقه بندی می شوند
عوامل ژنتیکی و بالینی
دو شکل اصلی: دیابت
نوع اول - وابسته به انسولین (IDDM) و دیابت
نوع دوم - مستقل از انسولین (NIDDM).
مقررات
سنتز zhk. آنزیم نظارتی
سنتز ال سی دی - استیل CoA کربوکسیلاز.
این آنزیم توسط چندین تنظیم می شود
راهها
فعال سازی / تفکیک
مجتمع زیر واحد آنزیمی. در
فرم غیرفعال استیل COA کربوکسیلاز
مجتمع های مجزا را نشان می دهد ،
که هر یک از 4 زیر واحد تشکیل شده است.
فعال کننده آنزیم سیترات است. تحریک می کند
در نتیجه ترکیب مجتمع ها
به موجب آن فعالیت آنزیم افزایش می یابد
. مهارکننده-پالمیتیل-CoA. او تماس می گیرد
تفکیک پیچیده و کاهش
فعالیت آنزیم.
فسفوریلاسیون / دفع فسفوریلاسیون
استیل CoA کربوکسیلاز. در
حالت جذب مجدد یا در
کار بدنی گلوکاگون شده
آدرنالین از طریق آدنیلات سیکلاز
سیستم توسط پروکیناز A و
تحریک فسفوریلاسیون زیر واحد
استیل CoA کربوکسیلاز. فسفریله شده
آنزیم غیرفعال و سنتز چربی است
اسیدها متوقف می شوند
جاذب
انسولین دوره فسفاتاز را فعال می کند ،
و استیل کوآ کربوکسیلاز وارد می شود
حالت دفسفریله شده سپس
تحت تأثیر سیترات رخ می دهد
پلیمریزاسیون پروتئین های آنزیم ، و
او فعال می شود. علاوه بر فعال سازی
آنزیم ، سیترات عمل دیگری را انجام می دهد
عملکرد در سنتز LCD. جاذب
دوره در میتوکندری سلولهای کبدی
سیترات را جمع می کند ، که در آن
باقیمانده آسیل به آن منتقل می شود
سیتوزول
مقررات
میزان اکسیداسیون β.
مسیر ب-اکسیداسیون و متابولیک ،
کاملاً مرتبط با کار CPE و عمومی است
راه های فاجعه آمیز. بنابراین سرعت آن است
تنظیم شده توسط نیاز به سلول
انرژی یعنی با نسبت ATP / ADP و NADH / NAD و همچنین میزان واکنش CPE و
مسیر مشترک کاتابولیسم. سرعت
اکسیداسیون β- در بافتها بستگی به در دسترس بودن دارد
بستر ، یعنی
مقدار چربی
اسیدهای موجود در میتوکندری.
غلظت اسیدهای چرب رایگان
در صورت فعال شدن خون در خون بالا می رود
لیپولیز در بافت چربی هنگام روزه گرفتن
تحت تأثیر گلوکاگون و در حین جسمی
تحت تأثیر آدرنالین کار کنید. در اینها
اسیدهای چرب می شوند
منبع غالب انرژی
برای عضلات و کبد ، در نتیجه
اکسیداسیون β توسط NADH و مهار کننده استیل-CoA تشکیل می شود
کمپلکس پیروات دهیدروژناز.
تحول در شکل گیری پیروات
از گلوکز تا استیل CoA کند می شود.
متابولیتهای میانی جمع می شوند
گلیکولیز و به ویژه گلوکز -6-فسفات.
گلوکز-6-فسفات هگزوکیناز را مهار می کند
و بنابراین دلسرد می شود
استفاده از گلوکز در این فرآیند
گلیکولیز بنابراین ، غالب است
استفاده از ال سی دی به عنوان منبع اصلی
انرژی در بافت عضلانی و کبد
گلوکز را برای بافت عصبی ذخیره می کند و
گلبولهای قرمز
میزان اکسیداسیون ب-نیز
بستگی به فعالیت آنزیم دارد
کارنیتین acyltransferases I
در کبد ، این آنزیم مهار می شود.
مالونیل CoA ، ماده ای تشکیل شده است
با بیوسنتز ال سی دی. در دوره جذب کننده
گلیکولیز در کبد و
تشکیل استیل-CoA افزایش می یابد
از پیروات. اولین واکنش سنتز
تبدیل ال سی دی استیل-CoA به مالونیل-CoA.
مالونیل CoA مهار اکسیداسیون β- ال سی دی ،
که می تواند برای سنتز استفاده شود
چربی
آموزش
مالونیل-CoA از استیل- CoA- تنظیم کننده
واکنش در بیوسنتز ال سی دی. اولین واکنش
سنتز تبدیل ال سی دی از استیل-CoA به
مالونیل CoA. آنزیم کاتالیزوری
این واکنش (استیل کوا کربوکسیلاز) ،
متعلق به کلاس لیگازهاست. او حاوی
بیوتین کووالانسی محدود شده است. در اول
مراحل واکنش کووالانسی CO2
به دلیل انرژی به بیوتین متصل می شود
ATP ، در مرحله 2 COO- منتقل شده است
روی استیل-CoA برای تشکیل مالونیل-CoA.
فعالیت آنزیم استیل CoA کربوکسیلاز
سرعت همه متعاقب آن را تعیین می کند
واکنش های سنتز
سیترات آنزیمی را در سیتوزول فعال می کند
استیل CoA کربوکسیلاز. مالونیل CoA در
به نوبه خود از انتقال بالاتر جلوگیری می کند
اسیدهای چرب از سیتوزول تا ماتریس
فعالیت مهاری میتوکندری
استیل CoA خارجی: کارنیتین آسیل ترانسفراز ،
بنابراین خاموش کردن اکسیداسیون بالاتر
اسیدهای چرب
استیل CoA Oxaloacetate
سیترات HS-CoA

HSCOA ATP Citrate → Acetyl-CoA ADP Pi Oxaloacetate
استیل-CoA
در سیتوپلاسم به عنوان بستر اولیه عمل می کند
برای سنتز ال سی دی ، و اکسالوواستات در
سیتوزول تحت تحولات در
در نتیجه پیروات شکل می گیرد.
بیوسنتز کلسترول
بیوسنتز کلسترول در شبکه آندوپلاسمی رخ می دهد. منبع همه اتمهای کربن موجود در این مولکول استیل-SCoA است که از میتوکندریا در سیترات ، دقیقاً مانند سنتز اسیدهای چرب ، از میتوکندری در اینجا به وجود می آید. بیوسنتز کلسترول 18 مولکول ATP و 13 مولکول NADPH مصرف می کند.
تشکیل کلسترول در بیش از 30 واکنش رخ می دهد که می توانند در چند مرحله گروه بندی شوند.
1. سنتز اسید ماوالونیک.
دو واکنش سنتز اول همزمان با واکنش کتوژنز است ، اما پس از سنتز 3-هیدروکسی-3-متیل گلوتاریل-ScoA ، آنزیم وارد می شود. هیدروکسی متیل گلوتاریل-ScoA ردوکتاز (HMG-SCOA ردوکتاز) ، تشکیل اسید میاوونیک.
 |