بیوشیمی انسولین و مکانیسم های اصلی عملکرد هورمون
هورمونهای پانکراس. مکانیسم عمل انسولین. علائم بیوشیمیایی دیابت
انسولین توسط سلولهای β از جزایر لانگرهان لوزالمعده به صورت یک پیش ساز - preproinsulin ساخته می شود. قطع توالی سیگنال از آن منجر به تشکیل پروینسولین می شود ، که از زنجیره های A و B تشکیل شده است و پپتید C که آنها را به هم وصل می کند. بلوغ پروهورمون در "برداشت" از پپتید C توسط پروتئینازها تشکیل شده است. انسولین بالغ حاوی زنجیره های A و B است که به وسیله دو پل دی سولفید متصل می شوند. زنجیره A حاوی 21 بقایای اسید آمینه و دارای یک پل دی سولفید است. زنجیره B از 30 باقیمانده اسید آمینه تشکیل شده است. تبدیل انسولین به انسولین در دستگاه Golgi آغاز می شود و در گرانول ترشحی سلولهای β سلولهای رسیده همچنان ادامه دارد.
انسولین به عنوان یک هورمون عمل فوری ، به سرعت (در مدت یک ساعت) سنتز می شود و با سرعت 40 واحد در روز ترشح می شود. محرک اصلی فیزیولوژیکی ترشح انسولین افزایش قند خون است. انسولین پروتئین حامل در پلاسما خون ندارد ، بنابراین نیمه عمر آن از 3-5 دقیقه تجاوز نمی کند. غلظت فیزیولوژیکی انسولین در خون 10 -12 - 10 -9 mol / L است.
بافتهای هدفمند انسولین عبارتند از: چربی ، ماهیچه و بافت كبد.
گیرنده های انسولین در غشای سلولی قرار دارند ، گلیکوپروتئین هستند ، از دو α- و دو زیرواحد β متصل شده توسط پیوندهای دی سولفید ، دارای فعالیت تیروزین کیناز هستند.
زیر واحد α کاملاً خارج از سلول است و به رسمیت شناختن اتصال انسولین کمک می کند. دو زیر واحد α توسط اوراق قرضه دی سولفید به یکدیگر وصل می شوند. β زیر واحد از غشای پلاسما عبور می کند و دارای یک منطقه بزرگ سیتوپلاسمی است که دارای فعالیت تیروزین کیناز است ، یعنی. توانایی فسفوریلات پروتئین در تیروزین - سایپرز ، باشگاه دانش
مکانیسم عمل انسولین. انسولین یکی از پروتئین های مورد مطالعه است: اولین پروتئین آن در هورمون های پروتئینی است که به صورت خالص ، متبلور و سنتز شیمیایی و توسط مهندسی ژنتیک به دست می آید. موفقیت های دانشمند در این زمینه به جوایز نوبل اعطا می شود. با این حال ، مکانیسم عملکرد آن در سطح مولکولی کاملاً از بیشتر هورمونها درک نشده است. مکانیسم عملکرد انسولین در حال حاضر به شرح زیر ارائه شده است. انسولین با اتصال به زیر واحد های گیرنده ، گیرنده تیروزین کیناز β زیر واحد را فعال می کند. اولین زیرلایه برای آن ، زیرواحد β ، یعنی خود آن است. اتوفسفریلاسیون گیرنده هنگامی که به انسولین متصل شود مشاهده می شود. علاوه بر این ، سیگنال ناشی از هورمون از دو جهت وارد سلول می شود:
گیرنده کیناز شامل آبشار فسفوریلاسیون تعدادی از آنزیم های سلولی است. این باعث ایجاد همخوانی در مولکول گیرنده و غشای سلولی می شود. در نتیجه ، نفوذپذیری سلولی برای اسیدهای آمینه گلوکز K + ، Ca 2+ ، افزایش می یابد. بنابراین ، پروتئینهای بستر گیرنده انسولین (IRS) فسفریله و فعال می شوند ، که پروتئین کینازهای سرین و ترئونین را فعال می کنند ، که فسفریلات (که در حال حاضر در بقایای سر یا Tre وجود دارد) پروتئین های مختلفی را فعال می کنند ، از جمله پروتئین فسفاتازها یعنی آنزیمهایی که باقیمانده فسفات را از فسفوپروتئینها جدا می کنند بنابراین ، عمل انسولین منجر به فسفوریلاسیون خاص برخی پروتئین ها و دفسفوریلاسیون سایر پروتئین ها می شود که فسفریلات در پاسخ به انسولین فسفریلات هستند و فعال می شوند: PDE ، cAMP ، پروتئین ریبوزومی 6S ، پروتئین های اسکلت سلولی (MAP-2 ، اکتین ، توبولین ، فودین و دیگر) فسفوریلاسیون پروتئینهای اسکلتی اسکلتی بلافاصله پس از اتصال انسولین به سلول ، انتقال سریع برگشت پذیر پروتئین های انتقال دهنده گلوکز (= حمل کننده گلوکز) از انبار داخل سلولی (وزیکول های EPR) به غشای پلاسما را تسهیل می کند. میزان جذب گلوکز در سلول 30 تا 40 برابر افزایش می یابد. حداقل 6 نوع حمل کننده گلوکز وجود دارد - GLUT-1 ، GLUT-2 و قبل از GLUT-6. همه آنها گلیکوپروتئین هستند.
با این حال ، بیشتر انسولین باعث افت دیفسفوریلاسیون پروتئین می شود. فعالیت آنزیم ممکن است:
افزایش - گلیکوژن سنتتاز ، استیل-COA کربوکسیلاز ، α-گلیسرول فسفات آسییل ترانسفراز ، پیروات دهیدروژناز ، پیروات کیناز هیدروکسی متیل گلوتاریل CoA ردوکتاز ،
کاهش - فسفوریلاز A ، فسفوریلاز B کیناز ، لیپاز بافتی ، کربوکسیلاز فسفنووپیروات و سایر آنزیمهای GNG.
جهت دیگر انتقال سیگنال از انسولین به سلول با فسفوریلاسیون تیروزین کیناز از یک گیرنده پروتئین G خاص است که می تواند به عنوان جینز تعیین شود. این منجر به فعال شدن یک فسفولیپاز C خاص می شود. ویژگی یک فسفولیپاز این است که وقتی انسولین تنها به گیرنده متصل شود و روی یک فسفولیپید طبیعی عمل نکند ، فعال می شود ، بلکه فقط در فسفولیپیدیلینوزیت گلیکان فعال می شود. بر خلاف فسفاتیلینلوزیتول ، این پیش ساز گلیکولیپید تنها باقیمانده اسیدهای چرب اشباع شده را شامل می شود و یک توالی کربوهیدرات به اینوزیتول اضافه می شود که شامل گالاکتوز ، گالاکتوزامین است. انسولین ، یک فسفولیپاز خاص C ، تشکیل دو واسطه را کاتالیز می کند: ساختار غیرمعمول DAG که حاوی فقط اسیدهای چرب اشباع شده و GIF است. لیپوفیل DAG در غشای پلاسما باقی مانده و حمل و نقل گلوکز ، اسیدهای آمینه و یون ها (K + ، Ca 2+) به سلول را تقویت می کند. آبگریز GIFF آزادانه در سیتوپلاسم حرکت می کند و فعالیت تعدادی از آنزیم ها را تغییر می دهد. بنابراين ، فعاليت هگزاكيناز ، فسفروفروكوكازاز ، گليسرول 3-فسفات آسيل ترانسفراز ، Na + / K + -ATPase افزايش مي يابد ، فعاليت آدنيلات سيكلاز ، PK A ، FEP-carboxylase و ساير آنزيم هاي GNG كاهش مي يابد.
مجموعه انسولین با گیرنده 30 ثانیه پس از اتصال ، تحت عمل اندوسیتوز (درونی سازی) قرار می گیرد و در سلول جدا می شود ، بیشتر این هورمون توسط پروتئینازهای لیزوزومی از بین می رود ، و گیرنده انسولین آزاد به طور عمده به سطح سلول باز می گردد (به اصطلاح بازیافت گیرنده).
اثرات بیولوژیکی انسولین
تاکنون ، جستجوی واسطه های ثانویه انسولین ادامه دارد. نقش آنها در مراحل اولیه مطالعه انسولین ادعا شده است: cGMP ، Ca 2+ ، NO ، H2ای2واسطه های تغییر یافته چربی (DAG ، GIF) ، پپتیدها و غیره با این حال ، این مسئله در نهایت حل نشده است (ساختار آنها رمزگشایی نشده است).
مکانیسم افزایش نفوذپذیری غشاء:
تغییرات ساختاری در پروتئین های غشای پلاسما در طول اتو فسفوریلاسیون گیرنده ،
فعال سازی مکانیسم های اختصاصی Na + / K + -ATPase ، پتاسیم. مبدل های بسیج حمل و نقل گلوکز ،
تغییرات در ترکیب PL غشاء (مهار PLdmethyltransferase).
تأثیر انسولین بر کربوهیدرات و متابولیسم لیپیدها تا حد زیادی به دلیل کاهش سطح AMP به دلیل مهار آدنیلات سیکلاز و فعال سازی PDE c AMP کاهش یافته است.
انسولین قند خون را توسط:
افزایش انتقال گلوکز در غشای پلاسمایی سلولهای هدف ،
افزایش استفاده از گلوکز. در سلول ، تقریباً نیمی از آن در گلیکولیز تحت تأثیر آنزیمهای کلیدی تجزیه می شوند - HA ، FFK ، PK. 30-40٪ گلوکز به سنتز لیپیدها می رود ، به خصوص در بافت چربی ، حدود 10٪ به سنتز گلیکوژن (فعال سازی گلیکوژن سنتاز) می روند ،
از طرف دیگر ، تجزیه گلیکوژن (مهار فعالیت فسفریلاز A) مهار می شود و GNG مهار می شود (به دلیل کاهش فعالیت آنزیم های کلیدی آن - کربوکسیلاز فسفوژنولپیروات ، فروکتوز بیس فسفاتاز و گلوکز-6-فسفاتاز و عدم حضور GNG + آمینولوتولپولولولها) . گلوکز GKoy و گویی "در سلول" قفل شده است ،
تقویت سنتز اسیدهای چرب (فعال سازی استیل CoA کربوکسیلاز)
تقویت سنتز TAG (فعال سازی گلیسیرفسفات acyltransferase)
مهار لیپولیز (کاهش فعالیت لیپاز بافت)
مهار تشکیل اجسام کتون (که عمدتا از گلوکز ، استیل- CoA تشکیل می شود به CC و سنتز لیپید می رود)
در خون ، فعال سازی لیپوپروتئین لیپاز مشاهده می شود ، که در TAG به عنوان بخشی از لیپوپروتئین ها (کلیومایکرون ها ، VLDL) عمل می کند ، در نتیجه سطح لیپمی را تنظیم می کند.
تقویت انتقال اسیدهای آمینه به داخل سلول
مهار شکست پروتئین به دلیل مهار پروتئینازهای بافتی
فعال سازی سنتز پروتئین. تأثیر سریع این هورمون در سنتز پروتئین (حداکثر تا یک ساعت) عمدتاً با تنظیم رونویسی و ترجمه مشخص می شود: شروع و کشیدگی زنجیره های پپتید تسریع می شود ، تعداد و فعالیت ریبوزوم ها افزایش می یابد ، فسفوریلاسیون پروتئین ribosomal S6 فعال می شود و به دنبال آن تشکیل پولیسموم ها انجام می شود. اگر عمل انسولین روی سلول بیش از 1 ساعت طول بکشد ، سنتز اسیدهای نوکلئیک افزایش می یابد ، که با تقسیم سلولی ، رشد و نمو کل همراه است.
بنابراین ، اثر انسولین بر متابولیسم می تواند به عنوان آنابولیک ، همراه با تعادل مثبت ازت شناخته شود.
اختلال در عملکرد هورمونی لوزالمعده
نسبتاً نادر است بیش از حد انسولین (کتاب درسی) ، کمبود هورمون اغلب مشاهده می شود. با کمبود انسولین یا مقاومت به انسولین (مقاومت در برابر عمل آن) ، دیابت ایجاد می شود. در روسیه ، دیابت حدود 1 میلیون 900 هزار نفر یا 1.2 درصد از کل جمعیت را مبتلا می کند. علاوه بر این ، در 16٪ بیماران ، دیابت وابسته به انسولین (IDDM) یا دیابت نوع 1. 84٪ از بیماران مبتلا به دیابت غیر وابسته به انسولین (NIDDM) یا دیابت نوع 2 هستند.
با دیابت نوع 1 یا دیابت نوع 1 ، كاهش سطح انسولین خون به دلیل آسیب به سلولهای β لوزالمعده ، یا غیرفعال كردن سریع در انسولین در كبد و خون مشاهده می شود. با وجود NIDDM یا دیابت نوع 2 ، سطح انسولین طبیعی است یا حتی بالا می رود ، اما سلول های هدف حساسیت خود را نسبت به آن از دست می دهند.
دلایل مقاومت به انسولین ممکن است:
نقض بلوغ هورمون و گیرنده آن با ظهور مولکولهای تغییر یافته و نقض عملکردهای بیولوژیکی آنها ،
وجود آنتی بادی در گیرنده های انسولین که در اتصال انسولین به گیرنده دخالت می کنند ،
نقض اندوسیتوز (داخلی سازی) مجموعه انسولین با گیرنده ، افزایش تخریب گیرنده های انسولین ،
نقص زودرس IR-ra ،
کاهش اتوفسفریلاسیون گیرنده و به دنبال آن اختلال در ایجاد واسطه انسولین و غیره
علاوه بر این ، هر بلوکی در مسیر انتقال سیگنال از هورمون به سلول می تواند به از دست دادن کامل یا جزئی از عملکرد انسولین بر متابولیسم حتی در غلظت بالای آن در بدن منجر شود.
علائم بیوشیمیایی دیابت
تغییرات دیابت پیر در متابولیسم تقریبا برعکس موارد ناشی از انسولین است. انتقال مواد به سلول کاهش می یابد ، محتوای C AMP افزایش می یابد ، یعنی. در بافت ها ، اثرات به اصطلاح هورمونهای ضد قارچی ، در درجه اول گلوکاگون ، شروع می شود و تغییرات متابولیسم مربوط به آن رخ می دهد. نشانه اصلی دیابت قند خون است که در نتیجه ایجاد می شود:
کاهش انتقال گلوکز به سلول ها ،
کاهش استفاده از گلوکز بافت (با IDDM ، تنها 5٪ گلوکز به چربی تبدیل می شود ، گلیکولیز و سنتز گلیکوژن مهار می شود)
افزایش تولید گلوکز (گلیکوژنولیز و GNG از اسیدهای آمینه).
گلوکز آزاد می تواند از سلول های داخل خون فرار کند. هنگامی که میزان پلاسما آن بیش از آستانه کلیه (10 میلی مول در لیتر) باشد ، گلوکوزی مشاهده می شود. در این حالت ، میزان ادرار به دلیل دیورز اسمزی افزایش می یابد ، یعنی. پلی اوریا ، کم آبی و پولییدپسی (مصرف بیش از حد آب) مشاهده می شود. گلوکزوزوری باعث از بین رفتن قابل توجهی کالری (4.1 کیلو کالری در هر گرم گلوکز دفع شده) می شود ، که همراه با فعال سازی پروتئولیز و لیپولیز ، علی رغم افزایش اشتها (چندشکستگی) منجر به کاهش شدید وزن بدن می شود.
غلبه لیپولیز بر لیپوژنز منجر به افزایش محتوای اسیدهای چرب در پلاسما می شود. هنگامی که از توانایی کبد در اکسیداسیون اسیدهای چرب در برابر دی اکسید کربن و آب تجاوز کند ، سنتز اجسام کتون فعال شده و کتونمی و کتونوری ، تغییر در pH خون با پیشرفت اسیدوز متابولیک مشاهده می شود. از بین بیماران بوی استون که حتی از راه دور احساس می شود ، بوجود می آید. اگر انسولین وارد نکنید ، بیمار در اثر کما دیابتی خواهد مرد. کاهش فعالیت لیپوپروتئین لیپاز نسبت کسری LP را تغییر می دهد ، به عنوان یک قاعده ، سطح VLDL و LDL افزایش می یابد ، که منجر به ایجاد آترواسکلروز می شود. با دیابت نوع 1 ، عروق کوچک اغلب بیشتر مبتلا می شوند ، یعنی میکروآنژیوپاتی ها ایجاد می شوند ، که به طور معمول می توانند خود را در قالب تصلب شرایین مغزی و اغلب به شکل بیماری ایسکمیک قلب نشان دهند. تصادفی نیست که اکنون دیابت نه تنها مشکل غدد درون ریز ، بلکه قلب شناسی نیز خوانده می شود.
سنتز پروتئین کاهش یافته ، فعال شدن پوسیدگی و کاهش حمل و نقل اسیدهای آمینه به سلول ها منجر به هایپرامینواسیدمی و آمینواسیدوریا می شود (یعنی از بین رفتن نیتروژن در ادرار). افزایش کاتابولیسم اسید آمینه منجر به افزایش سطح اوره در خون و افزایش دفع آن در ادرار می شود. بنابراین ، کمبود انسولین در انسان با تعادل نیتروژن منفی همراه است.
بنابراین ، علائم اصلی دیابت ذکر شده است. اشکال مختلف دیابت وجود دارد که از نظر شدت و در مجموعه علائم متفاوت است. بنابراین ، خفیف ترین اشکال بیماری (به اصطلاح دیابت قندی نهفته ، نهفته ، پیش دیابت) تنها با بزرگتر از هایپرگلیسمی معمولی بعد از خوردن غذا آشکار می شود ، یعنی کاهش تحمل گلوکز.
انواع مختلف دیابت را می توان با اختلال در ترشح هورمون های دیگر ، به عنوان مثال ، تیروئید مشخص کرد (کم کاری تیروئید شایع است ، که روند دیابت را پیچیده می کند ، عملکرد بیش از حد تیروئید در دیابت کمتر شایع است و عوارض کمتری نیز به همراه دارد).
بیوشیمیایی عوارض دیابت
علاوه بر تغییر در متابولیسم لیپیدها ، چربی خون در رشد آنها نقش زیادی دارد. این بافت ها در جایی که گلوکز به طور مستقل از انسولین نفوذ می کند ، تحت تأثیر قرار می گیرند: کلیه ها ، شبکیه و لنز چشم ، اعصاب و شریان ها. در آنها غلظت گلوکز همانند خون است ، یعنی بالاتر از حالت عادی این منجر به افزایش گلیکوزیلاسیون غیر بنزامی پروتئین ها ، به عنوان مثال ، کلاژن و سایر پروتئین های غشای زیرزمین می شود. گلیکوزیلاسیون خاصیت پروتئین ها را تغییر داده و عملکرد آنها را مختل می کند ، به عنوان مثال ، گلیکوزیلاسیون هموگلوبین میل آن به اکسیژن را افزایش می دهد ، بافت ها با اکسیژن بدتر تأمین می شوند. گلیکوزیلاسیون HDL منجر به تسریع کاتابولیسم آنها می شود و گلیکوزیلاسیون LDL باعث از بین رفتن آنها از خون و پوسیدگی می شود ، یعنی. سطح HDL کاهش می یابد و LDL افزایش می یابد ، که به پیشرفت آترواسکلروز کمک می کند. در برخی سلول ها (سلول های دیواره شریانی ، سلول های شوآن ، گلبول های قرمز ، لنز و شبکیه ، بیضه) گلوکز با تشکیل الکل 6 اتمی - سوربیتول در معرض آلدزو ردوکتاز وابسته به NADP قرار می گیرد. سوربیتول در غشای سلولی ضعیف نفوذ می کند ؛ تجمع آن منجر به تورم اسمزی سلول ها و عملکرد اختلال می شود. تورم عدسی و تجمع پروتئین های گلیکوزیله شده در آن منجر به کوفتگی و ایجاد آب مروارید می شود. اعصاب تحت تأثیر مویرگهای کلیه ها ، شبکیه (تا نابینایی) و غیره قرار دارند. به همین دلیل ، در درمان دیابت ، آنها تلاش می كنند سطح گلوكز را كه نزدیك به حد طبیعی است حفظ كنند.
مکانیسم عمل انسولین
بیوشیمی انسولین تقویت و تسریع در نفوذ گلوکز از طریق غشای سلولی است. تحریک اضافی انسولین دهها بار انتقال گلوکز را تسریع می کند.

مکانیسم عملکرد انسولین و بیوشیمیایی فرایند به شرح زیر است:
- پس از تجویز انسولین ، افزایش تعداد پروتئین های ویژه حمل و نقل در غشای سلولی رخ می دهد. این امر به شما امکان می دهد تا گلوکز را به سرعت و با کمترین انرژی از بین ببرید و مقدار بیشتری را در سلول های چربی فرآوری کنید. با کمبود تولید انسولین به خودی خود ، تحریک بیشتر انسولین برای حمایت از میزان مورد نیاز پروتئین های حمل و نقل لازم است.
- انسولین فعالیت آنزیمهای درگیر در سنتز گلیکوژن را از طریق یک زنجیره پیچیده از فعل و انفعالات افزایش می دهد و فرآیندهای پوسیدگی آن را مهار می کند.
بیوشیمی انسولین نه تنها مشارکت در متابولیسم گلوکز را شامل می شود. انسولین به طور فعال در متابولیسم چربی ها ، اسیدهای آمینه و سنتز پروتئین دخیل است. انسولین همچنین بر فرآیندهای رونویسی و تکثیر ژن تأثیر مثبت می گذارد. در قلب انسان ، عضله اسکلتی ، از انسولین برای رونویسی بیش از 100 ژن استفاده می شود
در کبد و در بافت چربی ، انسولین از تجزیه چربی ها جلوگیری می کند ، در نتیجه ، غلظت اسیدهای چرب به طور مستقیم در خون کاهش می یابد. بر این اساس ، خطر رسوب کلسترول در رگ ها کاهش می یابد و توان دیواره عروق احیا می شود.
سنتز چربی های موجود در کبد تحت تأثیر انسولین توسط آنزیم های استیل کواکربوکسیلاز و لیپوپروتئین لیپاز تحریک می شود. این خون را تمیز می کند ، چربی ها از جریان خون کلی خارج می شوند.
مشارکت در متابولیسم چربی شامل نکات کلیدی زیر است:
- سنتز اسیدهای چرب با فعال شدن استیل CoA کربوکسیلاز ،
- فعالیت لیپاز بافت کاهش می یابد ، روند لیپولیز مهار می شود ،
- مهار تشکیل اجسام کتون انجام می شود ، زیرا تمام انرژی به سنتز لیپید هدایت می شود.
سنتز بیولوژیکی و ساختار انسولین
این هورمون به شکل پیش پروینسولین در سلولهای بتا ویژه جزایر لانگرهان واقع در لوزالمعده ساخته می شود. حجم کل جزایر حدود 2٪ از کل جرم غده است. با کاهش فعالیت جزایر ، کمبود هورمونهای سنتز شده ، قند خون ، ایجاد بیماری های غدد درون ریز رخ می دهد.
پس از جدا شدن زنجیره های سیگنال ویژه از پروپرووینولین ، پروینسولین تشکیل می شود که از زنجیره های A و B با یک اتصال C-petid تشکیل شده است. با بالغ شدن هورمون ، پروتئینازها زنجیره پپتید را جذب می کنند که با دو پل دی سولفید جایگزین می شوند. پیری در دستگاه گلگی و گرانول ترشحی سلولهای بتا رخ می دهد.
هورمون بالغ حاوی 21 اسید آمینه در زنجیره A و 30 اسید آمینه در زنجیره دوم است. سنتز به طور متوسط حدوداً یک ساعت طول می کشد ، همانطور که بیشتر هورمونهای سریعاً فعال است. این مولکول پایدار است ، اسیدهای آمینه جایگزین در قسمت های ناچیز زنجیره پلی پپتید یافت می شوند.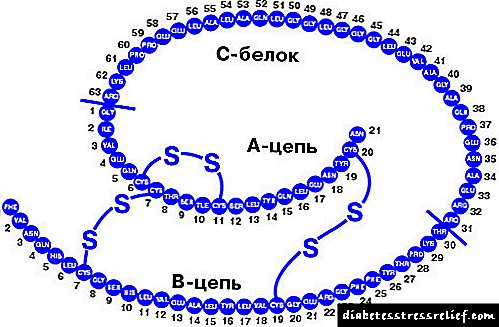
گیرنده های مسئول متابولیسم انسولین گلیکوپروتئین هایی هستند که به طور مستقیم بر روی غشای سلولی قرار دارند. پس از ضبط و فرآیندهای متابولیکی ، ساختار انسولین از بین می رود ، گیرنده به سطح سلول باز می گردد.
محرکی که باعث آزاد شدن انسولین می شود ، افزایش قند خون است. در صورت عدم وجود پروتئین ویژه - حمل کننده در پلاسمای خون ، نیمه عمر حداکثر 5 دقیقه است. برای حمل و نقل نیازی به پروتئین اضافی وجود ندارد ، زیرا هورمون ها مستقیماً وارد ورید لوزالمعده و از آنجا به ورید پورتال می شوند. کبد هدف اصلی هورمون است. هنگامی که وارد کبد می شود ، منبع آن تا 50٪ هورمون تولید می کند.
علیرغم اینکه اصول عمل با پایه شواهد - سگی با دیابت مصنوعی هنگام برداشتن لوزالمعده ، در اواخر قرن نوزدهم ارائه شد ، در سطح مولکولی ، مکانیسم تعامل همچنان باعث بحث و گفتگوهای داغ می شود و کاملاً درک نشده است. این در مورد همه واکنش های ژن ها و متابولیسم هورمونی صدق می کند. برای درمان دیابت ، انسولین خوک و گوساله در دهه 20 قرن بیستم استفاده شد.
خطر کمبود انسولین در بدن چیست؟
با کمبود تولید طبیعی انسولین یا با مصرف کربوهیدرات زیاد از مواد غذایی ، پیش نیازهای لازم برای ایجاد دیابت قند ، یک بیماری متابولیک سیستمیک است.
علائم زیر به عنوان علائم اولیه مرحله اولیه اختلالات متابولیک تبدیل می شوند:
- عطش مداوم ، کم آبی. متخصصان تغذیه مبلغی را که از نوشیدن آب در دست است ستایش می کنند. در حقیقت ، این بیماری قبل از دیابت قندی است و می تواند چندین ماه یا حتی سالها ادامه داشته باشد. این وضعیت به ویژه برای سوء مصرف کنندگان گلوکز ، علاقه مندان به تناسب اندام ، نمایندگان کارهای ذهنی با کار بی تحرک و فعالیت مغز فعال مشخص است.
- تکرر ادرار. دوستداران تناسب اندام خوشحال می شوند - وزن طبیعی است ، بدن سموم را از بین می برد. کارگران بی تحرک بر این باورند که مواد منعکس کننده کار کرده اند. اگر حجم کل مایعات ساطع شده بیش از 4-5 لیتر باشد ، این یک علامت دردناک است.
- ضعف در عضلات ، حالت خستگی مداوم ، خستگی.
- کتونمی ، درد در کلیه ها ، کبد ، بوی استون از دهان یا ادرار.
- واکنش مثبت فوری بدن به شیرینی ها - ظرفیت کار احیا می شود ، نیروها و ایده های جدید ظاهر می شوند.
- آزمایش خون علاوه بر قند خون بالا ، افزایش اسیدهای چرب به ویژه کلسترول را نشان می دهد. آزمایش ادرار وجود استون در ادرار را نشان می دهد.

شناخت مکانیسم عملکرد انسولین و بیوشیمیایی کلی فرآیندهای موجود در بدن به ایجاد رژیم صحیح کمک می کند و با استفاده از دوزهای زیاد گلوکز به شکل خالص آن ، به عنوان مثال ، به عنوان یک محرک سبک ، یا دوزهای بالای کربوهیدراتهای سریع بدن ، بدن را به خطر نمی اندازد.
خطر افزایش غلظت انسولین
با افزایش تغذیه ، افزایش محتوای کربوهیدرات در مواد غذایی ، فشار شدید بدنی ، تولید طبیعی انسولین افزایش می یابد. از آماده سازی انسولین در ورزش برای افزایش رشد بافت ماهیچه ها ، افزایش استقامت و بهبود تحمل ورزش استفاده می شود.
وقتی بار متوقف شود یا رژیم تمرینی ضعیف شود ، ماهیچه ها به سرعت پوسته پوسته می شوند و روند رسوب چربی رخ می دهد. تعادل هورمونی مختل شده است ، که منجر به دیابت نیز می شود.
در دیابت نوع 2 ، تولید انسولین در بدن در حد طبیعی باقی می ماند ، اما سلول ها در برابر اثرات آن مقاوم می شوند. برای دستیابی به یک اثر طبیعی ، افزایش قابل توجهی در میزان هورمون مورد نیاز است. در نتیجه مقاومت در برابر بافت ، تصویر کلینیکی کلی مشاهده می شود ، مشابه کمبود هورمون ، اما با تولید بیش از حد آن.
چرا از نظر فرآیندهای بیوشیمیایی لازم است سطح قند خون در حد نرمال حفظ شود
به نظر می رسد انسولین سنتز شده قادر است مشکل عوارض دیابت را به طور کامل برطرف کند ، گلوکز را به سرعت از بین ببرد و متابولیسم را عادی کند. بر این اساس ، کنترل سطح قند بی معنی است. اما این طور نیست.
هایپرگلیسمی بر بافتهایی که گلوکز بدون مشارکت انسولین آزادانه در آن نفوذ می کند ، تأثیر می گذارد. سیستم عصبی ، سیستم گردش خون ، کلیه ها و اندام بینایی رنج می برند. افزایش سطح گلوکز بر عملکردهای اصلی پروتئینهای بافت تأثیر می گذارد و به دلیل تغییر در هموگلوبین ، میزان اکسیژن رسانی به سلولها بدتر می شود.
گلیکوزیلاسیون عملکرد کلاژن - افزایش شکنندگی و آسیب پذیری رگ های خونی را مختل می کند ، که منجر به ایجاد آترواسکلروز می شود. عوارض بارز قند خون شامل تورم چشم بلوری ، آسیب شبکیه و ایجاد آب مروارید است. بافت ها و مویرگهای کلیه ها نیز تحت تأثیر قرار می گیرند. با توجه به خطر عوارض ، در درمان دیابت توصیه می شود قند را در حد نرمال نگه دارید.
حدود 6٪ از جمعیت اکثر کشورهای توسعه یافته از اشکال وابسته به انسولین به دیابت رنج می برند و مقدار مشابه آن به طور جدی خطرناک به وابستگی به انسولین است. این تعداد زیاد است که با مقیاس مصرف هورمون مصنوعی تأیید می شود.
مصرف زیاد قند ، به ویژه در قالب نوشیدنی ها ، کربوهیدرات های سریع ، متابولیسم انسان را لرزاند و باعث تحریک بیماری های دژنراسیون و بیماری ها می شود. هر ساله تعداد افراد وابسته به انسولین که به اشکال برون زای هورمون نیاز دارند به دلیل مصونیت آنها نسبت به طبیعی در حال افزایش است.